题目内容
【题目】设NA为阿伏伽德罗常数的值.下列叙述错误的是
A.7.8gNa2O2与过量水反应转移电子数为0.1NA
B.1 mol OD-离子含有的质子、中子数均为9NA
C.46g NO2和N2O4混合气体中含有原子总数为3NA
D.已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
【答案】D
【解析】
根据题中NA为阿伏伽德罗常数可知,本题考查阿伏伽德罗常数的相关计算,运用阿伏伽德罗常数的计算公式和物质的组成结构分析。
A.依据![]() 计算物质的量
计算物质的量![]() ,结合1mol过氧化钠和水反应电子转移为1mol,0.1mol过氧化钠和水反应电子转移为0.1mol,即0.1NA,故A正确;
,结合1mol过氧化钠和水反应电子转移为1mol,0.1mol过氧化钠和水反应电子转移为0.1mol,即0.1NA,故A正确;
B.1个 OD-离子含有的质子、中子数均为9个,因此1 mol OD-离子含有的质子、中子数均为9NA,故B正确;
C. NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故原子总数为3NA,故C正确;
D.已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ·mol﹣1,表示当此反应完全进行时,反应中有6NA个电子转移时,放出92.4 kJ的热量,但此反应是可逆反应,不可能完全进行,因此当有3NA个电子转移时,△H>﹣46.2kJ·mol﹣1,故D错误;
2NH3(g)△H=﹣92.4kJ·mol﹣1,表示当此反应完全进行时,反应中有6NA个电子转移时,放出92.4 kJ的热量,但此反应是可逆反应,不可能完全进行,因此当有3NA个电子转移时,△H>﹣46.2kJ·mol﹣1,故D错误;
答案选D。

 课时训练江苏人民出版社系列答案
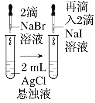
课时训练江苏人民出版社系列答案【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
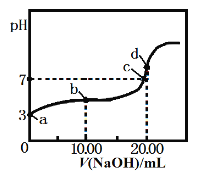
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同