题目内容
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。

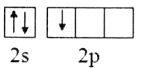
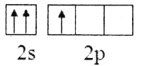
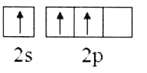
(1)Mn2+的核外电子排布式为__;有机高聚物中C的杂化方式为__。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为__。
(3)NO2-的空间构型为__。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是__,O2的键能是__,MnO的晶格能是__。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为__(用元素符号表示)。已知其晶胞边长为a cm,则该晶胞的密度为__g·cm-3(阿伏加德罗常数用NA表示)。

【答案】1s22s22p63s23p63d5 sp2、sp3 3:4 V形 b kJ·mol-1 2e kJ·mol-1 (f-a-b-c-d-e) kJ·mol-1 ZnS ![]()
【解析】
(1)锰原子的电子排布式为1s22s22p63s23p63d54s2,由此可确定Mn2+的核外电子排布式;有机高聚物中C的价层电子对数分别为3和4,由此可得出杂化方式;
(2)已知CN-与N2互为等电子体,可推出拟卤素(CN)2分子结构为N≡C-C≡N,由此可推出σ键与π键数目之比;
(3)NO2-的价层电子对数为![]() =3,由此可确定空间构型;
=3,由此可确定空间构型;
(4)Mn的第一电离能是指由Mn(g)→Mn+时吸收的能量,O2的键能是指破坏1mol O2分子内 共价键所需吸收的能量,MnO的晶格能可利用盖斯定律求出;
(5)R(晶胞结构如图)由Zn、S组成,利用均摊法,可求出晶胞中所含有的Zn、S原子数,从而确定其化学式。已知其晶胞边长为a cm,可求出1个晶胞的体积和质量,从而求出该晶胞的密度;
(1)锰原子的电子排布式为1s22s22p63s23p63d54s2,则Mn2+的核外电子排布式为1s22s22p63s23p63d5;有机高聚物中C的价层电子对数分别为3和4,则杂化方式分别为sp2、sp3;答案:1s22s22p63s23p63d5;sp2、sp3;
(2)已知CN-与N2互为等电子体,可推出拟卤素(CN)2分子结构为N≡C-C≡N,则σ键为3个,π键为4个,从而得出σ键和π键为数目之比为3:4;答案为:3:4;
(3)NO2-的价层电子对数为![]() =3,N与2个O各形成共价双键,另有一对孤对电子,对成键电子有排斥作用,从而使结构不对称,由此可确定空间构型为V形;答案为:V形;
=3,N与2个O各形成共价双键,另有一对孤对电子,对成键电子有排斥作用,从而使结构不对称,由此可确定空间构型为V形;答案为:V形;
(4)由图中可知,Mn(g)→Mn+时吸收的能量为b kJ·mol-1,则Mn的第一电离能为b kJ·mol-1;键能是指破坏1mol O2分子内共价键所需吸收的能量,由图中可确定O2的键能是2e kJ·mol-1;MnO的晶格能可利用盖斯定律,按箭头所指方向,MnO的晶格能为(f-a-b-c-d-e) kJ·mol-1;答案为:b kJ·mol-1;2e kJ·mol-1;(f-a-b-c-d-e) kJ·mol-1;
(5)R(晶胞结构如图)由Zn、S组成,利用均摊法,可求出晶胞中所含有的Zn、S原子数分别为4,从而确定其化学式为ZnS;已知其晶胞边长为a cm,可求出1个晶胞的体积和质量,从而求出该晶胞的密度为![]() =
=![]() g·cm-3;答案为:
g·cm-3;答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案