��Ŀ����
����Ŀ��NԪ���γɵĻ�����ḻ��ʣ��Իش��������⣺
(1)������ͭ��Һ����μ��백ˮ�Ȳ���������������ܽ�Ϊ����ɫ��Һ,�����Ҵ���������ɫ���塣
�ٻ�̬ͭԭ�ӵĺ�������Ų�ʽΪ________________��
��1mol����ɫ������������к��еĦҼ�����ĿΪ___________��
�ۼ�Ҫ����Ϊʲô�����Ҵ����о�������_____________________________��
(2)��֪���ǻ������ĽṹʽΪ![]() ���Ƚϣ����ǻ������ķе�_____________���ǻ������ķе�(����ڡ��� �����ڡ��� ����ȷ����);���̷��¼��е������������谷���ṹ��ʽΪ
���Ƚϣ����ǻ������ķе�_____________���ǻ������ķе�(����ڡ��� �����ڡ��� ����ȷ����);���̷��¼��е������������谷���ṹ��ʽΪ![]() ���÷����е�ԭ�ӵ��ӻ���ʽΪ________________;����Ͷ������������Nһ����������,�ṹ��ʽΪ
���÷����е�ԭ�ӵ��ӻ���ʽΪ________________;����Ͷ������������Nһ����������,�ṹ��ʽΪ![]() ,��÷������漰�ĵڶ�����Ԫ�ص�һ��������С�����˳��Ϊ____________________��
,��÷������漰�ĵڶ�����Ԫ�ص�һ��������С�����˳��Ϊ____________________��
(3)��֪CuN3�е���������CO2��Ϊ�ȵ����壬CuN3����ľ������Ȼ��Ƶľ������ơ�
����д��CuN3�е������ӵĵ���ʽ__________________��
����֪�þ��徧���߳�a,b,c,��ϵΪa=b___________����
(4)��֪NH3,NF3,N(CH3)3��������ͭ�������������ӡ�
���ȶ���[Cu(NH3)4]2+__________[Cu(NF3)4]2+��(����ڡ�, �����ڡ�,����ȷ���� )
����֪�ȶ���[Cu(NH3)4]2+����[Cu[N(CH3)3]4]2+,���Ҫ����ԭ��_______________________��
���𰸡� 1s22s22p63s23p63d104s1 16NA �����Ҵ��������ܼ��ļ���,������ܽ�Ƚ��� ���� sp2,sp3 C<O<N ![]() 4 ���� N(CH3)3�����,�ռ�ӵ��
4 ���� N(CH3)3�����,�ռ�ӵ��
��������(1) ��ͭΪ29��Ԫ�أ���̬ͭԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1���ʴ�Ϊ��1s22s22p63s23p63d104s1��
��1mol����ɫ�����������Ϊ[Cu(NH3)4]2+�����к��е�������Cuԭ����Nԭ�Ӽ����λ���Ͱ��������еĹ��ۼ�����ĿΪ16NA���ʴ�Ϊ��16NA��
�ۼ����Ҵ��������ܼ��ļ��ԣ�������ܽ�Ƚ��ͣ���˼����Ҵ�����[Cu(H2O)4]SO4H2O�����������ʴ�Ϊ�������Ҵ��������ܼ��ļ��ԣ�������ܽ�Ƚ�����
(2)���ǻ����������γɷ�����������е㽵�ͣ����ǻ����������γɷ��Ӽ�������е����ߣ�������ǻ������ķе���ڶ��ǻ������ķе㣻�����谷�����У������ϵ�Nԭ�Ӻ���3���� ����һ���µ��Ӷԣ����Բ�ȡsp3�ӻ������ϵ�Nԭ�Ӻ���2���� ����һ���µ��Ӷԣ����Բ�ȡsp2�ӻ��� ![]() ���������漰�ĵڶ�����Ԫ��ΪC��N��O��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����N��2pΪ������ṹ����Ϊ�ȶ�����һ��������С�����˳��ΪC<O<N���ʴ�Ϊ�����ڣ�sp2��sp3��C<O<N��
���������漰�ĵڶ�����Ԫ��ΪC��N��O��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����N��2pΪ������ṹ����Ϊ�ȶ�����һ��������С�����˳��ΪC<O<N���ʴ�Ϊ�����ڣ�sp2��sp3��C<O<N��
(3)��CuN3�е���������CO2��Ϊ�ȵ����壬�ṹ�������̼���ƣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��CuN3����ľ������Ȼ��Ƶľ������ƣ��þ��徧���߳�a��b��c����ϵΪa=b<c�����ṹΪ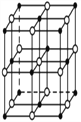 �����������������������4�����ʴ�Ϊ��4��
�����������������������4�����ʴ�Ϊ��4��
(4)��F�ĵ縺�Ա�N��N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӣ�����ȶ���[Cu(NH3)4]2+����[Cu(NF3)4]2+���ʴ�Ϊ�����ڣ�
��N(CH3)3����ռ�ӵ���������ȶ���[Cu(NH3)4]2+����[Cu[N(CH3)3]4]2+���ʴ�Ϊ��N(CH3)3����ռ�ӵ����

����Ŀ�������£���ijBa��OH��2��Һ����μ���pH=x�����ᣬ��û����Һ�IJ���pH�����ʾ��
��� | ����������Һ�����/mL | ��������/mL | ��Һ��pH |
�� | 22.00 | 0.00 | 13 |
�� | 22.00 | 18.00 | 12 |
�� | 22.00 | 22.00 | 7 |
��1��Ba��OH��2��Һ�����ʵ���Ũ��Ϊ��
��2��x��ֵ�Ƕ��٣�
��3����100mL����Ba��OH��2��Һ����μ���0.05mol/L NaHCO3��Һ���������պô����ֵʱ��Һ��pHΪ���٣�����֪lg2=0.3��