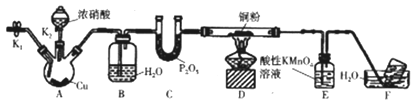
题目内容
【题目】常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:
序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 13 |
② | 22.00 | 18.00 | 12 |
③ | 22.00 | 22.00 | 7 |
(1)Ba(OH)2溶液的物质的量浓度为?
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
【答案】
(1)0.05mol/L
(2)1
(3)12.4
【解析】解:(1)根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]=
mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]= ![]() ×c(OH﹣)=
×c(OH﹣)= ![]() ×0.1mol/L=0.05mol/L,
×0.1mol/L=0.05mol/L,
故答案为:氢氧化钡物质的量浓度为0.05mol/L;
(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH﹣),因为体积相同,所以酸中c(H+)等于碱中c(OH﹣)为0.1mol/L,所以x=1,
故答案为:x值为1;
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,设碳酸氢钠的体积为xL,则0.05mol/L×0.1L=0.05mol/L×xL,x=0.1,混合溶液中n(NaOH)=n(NaHCO3)=0.05mol/L×0.1L=0.005mol,c(NaOH)= ![]() =0.025mol/L,溶液中c(H+)=
=0.025mol/L,溶液中c(H+)= ![]() mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
故答案为:混合溶液的pH为12.4.
(1)根据氢氧化钡溶液的pH计算其物质的量浓度;
(2)根据混合溶液的pH=7计算盐酸的w物质的量浓度,然后计算其pH;
(3)根据沉淀量达到最大值的反应方程式计算溶液中氢氧根离子浓度,然后计算pH.

【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)
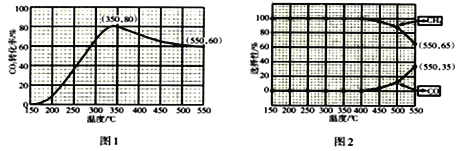
①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
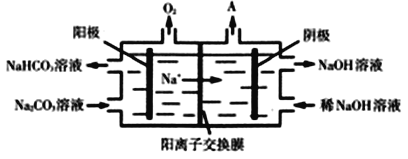
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 | 需除杂的物质 | 试剂 | 操作 |
A | NaCl(Na2CO3) | 稀盐酸 | 蒸发结晶 |
B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | CO2(CO) | ﹣﹣ | 点燃 |
A.A
B.B
C.C
D.D