题目内容
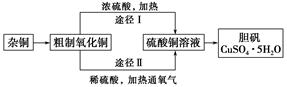
(10分)混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化,据此回答有关问题: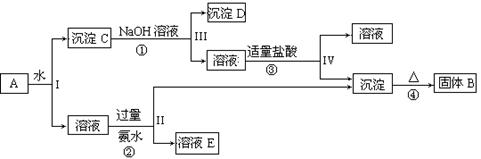
(1)I、II、III、IV中溶液和沉淀分离采取的实验操作需要用到的玻璃仪器是 、 、 。 固体B的化学式为 。
(2)按要求写出上述过程①、②、③中发生的主要反应的离子方程式
① 。
② 。
③ 。
(10分)
(1)玻璃棒、烧杯、漏斗。Al2O3(每空1分)
(2)(每空2分)
①Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2[Al(OH)4]-
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③AlO2-+H++H2O=Al(OH) 3↓或[Al(OH)4]-+H+= H2O+Al(OH) 3↓
解析试题分析:(1)I、II、III、IV操作都是过滤操作,需要的玻璃仪器有玻璃棒、烧杯、漏斗;沉淀C是氧化铝、氧化铁的混合物,加氢氧化钠溶液后沉淀D是氧化铁,所以得到的溶液是偏铝酸钠溶液,加入适量盐酸可以生成氢氧化铝沉淀,氢氧化铝受热分解得氧化铝,所以固体B的化学式为Al2O3;
(2)①为氧化铝与氢氧化钠溶液的反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O;②为硫酸铝钾中的铝离子与氨水反应生成氢氧化铝沉淀,Al3++3NH3·H2O=Al(OH) 3↓+3NH4+;③为偏铝酸根离子与氢离子反应生成氢氧化铝沉淀,离子方程式是AlO2-+H++H2O=Al(OH) 3↓。
考点:考查过滤操作仪器的选择,铝元素及其化合物的化学性质,离子方程式的书写

 53随堂测系列答案
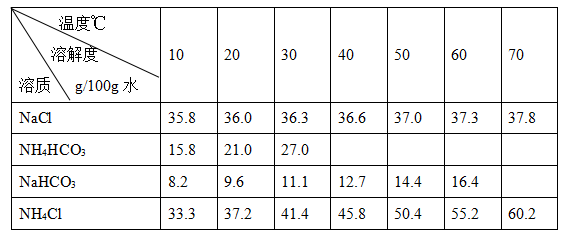
53随堂测系列答案NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )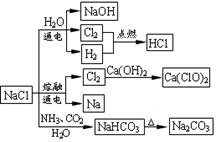
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2与铁不反应 |
| D.图中所示转化反应都是氧化还原反应 |
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是 。氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。

 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol