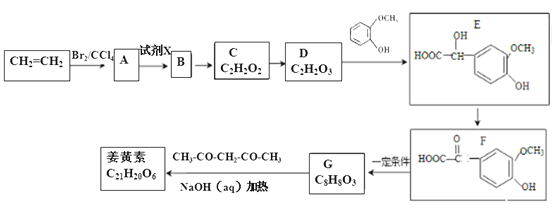
题目内容
【题目】随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
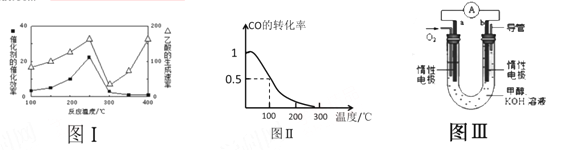
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
【答案】(1)(2a+b+2c)
(2)①250 ②3Cu2Al2O4 + 32H+ + 2NO3- = 6Cu2+ + 6Al3+ + 2NO↑+ 16H2O
(3)①放热 ② 增大 ③a2/V2
(4)①b ② CH3OH + 8OH- - 6e- = CO32- + 6H2O
【解析】
试题分析:(1)①SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①;2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②;2HI(g) = H2(g) + I2(g) H= c kJ/mol ③,依据盖斯定律①×2+②+③×2得到2H2O(g)=2H2(g)+O2(g)△H=(2a+b+2c)kJ/mol.
(2)①根据图示可知,在250℃左右,催化剂的催化效率和乙酸的生成速率最大,因此该反应体系应将温度控制在250℃左右。
②Cu2Al2O4中Cu为+1价,Cu2Al2O4与硝酸生成硝酸铜、硝酸铝、NO和水,根据得失电子相等、电荷守恒、质量守恒配平,则Cu2Al2O4 溶解在稀硝酸中的离子方程式为3Cu2Al2O4 + 32H+ + 2NO3- = 6Cu2+ + 6Al3+ + 2NO↑+ 16H2O。
(3)①根据图像可知,温度升高,CO的转化率降低,说明平衡向逆反应方向移动,而升高温度,平衡向吸热反应方向移动,所以该反应为放热反应;
②该反应是气体体积缩小的可逆反应,在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,相当于增大压强,平衡向正反应方向移动,达到新平衡时,CO的转化率增大;
③100℃时,CO的转化率为0.5,设有a mol CO与2a mol H2 ,容器的体积为V,根据三段式
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始物质的量 a 2a 0
变化物质的量 0.5a a 0.5a
平衡物质的量 0.5a a 0.5a
K=(0.5a/V)÷[(a/V)2×0.5a/V]= V2/a2,反应逆向进行,平衡常数互为倒数,所以100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为a2/V2
CO(g) + 2H2(g) 的平衡常数为a2/V2
(4)①甲醇燃料电池,氧气得电子发生还原反应,在正极放电,a为正极,b为负极,阴离子移向负极,则该电池工作时,OH- 向b极移动;
②甲醇作燃料的电池示意图中,KOH作电解质,甲醇反应生成的二氧化碳与KOH反应生成碳酸钾,所以该电池负极反应的电极反应式为CH3OH + 8OH- - 6e- = CO32- + 6H2O。