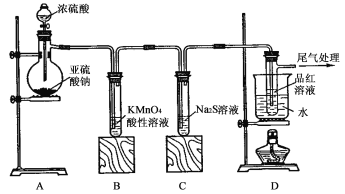
��Ŀ����
����Ŀ������������Ҫ��FeS2��SiO2�ȣ��Ʊ�Ī���ε��������£�
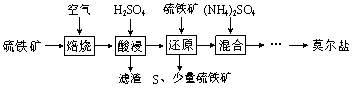
��֪������ԭ��ʱ��FeS2��H2SO4����Ӧ��Fe3+ͨ����Ӧ��ԭ�����з�Ӧ�����£�
2Fe3++ FeS2=2S��+3Fe2+
��1������ԭ��ʱ��pH���˹��ߵ�ԭ����_________��д������ԭ��ʱ��Ӧ������ӷ���ʽ��__________��
��2��ʵ���á���ԭ��ʱ��Ӧ���б���ԭ��Fe3+�����ʵ���֮��Ϊ2��7�����㡰��ԭ������ҺFe2+��Ũ�ȼ���ȷ����������(NH4)2SO4��������Һ����仯���Բ��ƣ�
���� | ����Ũ�ȣ�mol��L��1�� | |
��ԭǰ | ��ԭ�� | |
SO42�� | 3.20 | 3.50 |
Fe2+ | 0.15 | |
��3����ȡ23.52g����Ī���Σ�����ˮ�����Һ���ֳ����ȷݡ�һ�ݼ���������BaCl2��Һ���õ���ɫ����13.98g����һ����0.2000mol/LK2Cr2O7������Һ�ζ�����Cr2O72-ǡ����ȫ����ԭΪCr3+ʱ��������Һ�����Ϊ25.00mL����ȷ��Ī���εĻ�ѧʽ�������������̣���
���𰸡���1��pH����ʱ��Ԫ�ؽ��������²��ʽ��� FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42�� + 16H+
��2��3.30 ��3��FeSO4��(NH4)2SO4��6H2O
��������
�����������1����Һ���Fe3+��Fe2+��ˮ�⣬����ԭ��ʱ��pH����ٽ�Fe3+��Fe2+ˮ�����ɳ�������pH����ʱ��Ԫ�ؽ��������²��ʽ��ͣ����Բ���̫�ߣ�����ԭ��ʱ��Ӧ������ӷ���ʽΪFeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42�� + 16H+��
��2��������Һ���Ϊ1L�����ݱ���֪����Ӧ�������ɵ�����������ʵ���Ϊ(3.50 mol��L��1��3.20mol��L��1)��1L=0.3mol���ݷ�ӦFeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+��֪����Ӧ���б���ԭ��Fe3+�����ʵ���Ϊ2.1mol��ͬʱ��������ɵ��������ӵ����ʵ���Ϊ2.25mol����Ӧ���б���ԭ��Fe3+�����ʵ���Ϊ0.6mol��ͬʱ��������ɵ��������ӵ����ʵ���Ϊ0.9mol����Һ�����ӵ��������ӵ����ʵ���Ũ��Ϊ��0.9mol+2.25mol����1L=3.15mol��L��1����ԭ��Fe2+�����ʵ���Ũ��Ϊ0.15mol��L��1+3.15mol��L��1��3.30mol��L��1 .
��3���������⣬n(SO42��)��13.98g��223g/mol��0.06mol��
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000molL-1��0.025L������n(Fe2+)=0.005 mol��6=0.03mol��
���ݵ���غ���n(NH4+)+2n(Fe2+)=2n(SO42-)��n(NH4+)=0.06mol��
n(H2O)= 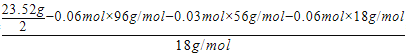 =0.18 mol��
=0.18 mol��
����n(SO42-)��n(Fe2+)��n(NH4+)��n(H2O)=0.06mol��0.03mol��0.06mol��0.18mol=2��1��2��6����Ī���εĻ�ѧʽΪ(NH4)2Fe(SO4)26H2O[��(NH4)2SO4FeSO46H2O]��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�