题目内容
【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
【答案】B
【解析】
反应的方程式为4NO2(g)+O2(g)![]() 2N2O5(g) △H<0,起始时加入n(NO2)=8mol,n(O2)=2mol,由表中数据可知n1=5,n2=4,n3=1。则
2N2O5(g) △H<0,起始时加入n(NO2)=8mol,n(O2)=2mol,由表中数据可知n1=5,n2=4,n3=1。则
A、体积为2L,5s内二氧化氮浓度变化为3mol÷2L=1.5mol/L,则5s内NO2的平均反应速率为1.5mol/L÷5s=0.3 mol/(Ls),故A正确;
B、若10s时,再向容器中充入2molN2O5(g),相当于在原来的基础上增大压强,平衡正向移动,则NO2的体积分数将减小,故B错误;
C、正反应为放热反应,绝热恒容下,容器温度升高,平衡逆向移动,则新平衡下的平衡常数比原平衡的小,故C正确;
D、体积为2L,则根据方程式可知
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
起始浓度(mol/L) 4 1 0
转化浓度(mol/L) 2 0.5 1
平衡浓度(mol/L) 2 0.5 1
则该反应的平衡常数为![]() =0.125
=0.125
反应物的平衡转化率为2/4×100%=50%,故D正确。
答案选B。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
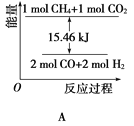
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。