题目内容
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 由H2、碘蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 加压可使更多的SO2转化为SO3
D. 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去。
【答案】A
【解析】
化学平衡移动的原理也称勒夏特列原理,其内容是:如果改变影响平衡的条件之一(如温度、压强、参加反应的化学物质的浓度)平衡将向着能够减弱这种改变的方向移动。
A. H2、碘蒸气、HI组成的平衡为H2(g)+I2(g)![]() 2HI(g),给平衡体系加压时反应混合气体的体积将减小,各组分的浓度将增大,包括呈紫色的碘蒸气的浓度增大,所以体系的颜色变深,该平衡状态并没有移动,所以由H2、碘蒸气、HI组成的平衡体系加压后颜色变深的事实不能用勒夏特列原理解释,A项正确;
2HI(g),给平衡体系加压时反应混合气体的体积将减小,各组分的浓度将增大,包括呈紫色的碘蒸气的浓度增大,所以体系的颜色变深,该平衡状态并没有移动,所以由H2、碘蒸气、HI组成的平衡体系加压后颜色变深的事实不能用勒夏特列原理解释,A项正确;
B.Cl2呈黄绿色,溶解在水的Cl2分子部分与水反应Cl2+H2O![]() HCl+HClO并达到平衡状态,生成的HClO在光照下发生分解反应2HClO
HCl+HClO并达到平衡状态,生成的HClO在光照下发生分解反应2HClO![]() 2HCl+O2↑,氯水受光照时HClO逐渐分解,HClO浓度减小,根据勒夏特列原理Cl2+H2O
2HCl+O2↑,氯水受光照时HClO逐渐分解,HClO浓度减小,根据勒夏特列原理Cl2+H2O![]() HCl+HClO平衡向正反应方向移动,溶解的Cl2分子逐渐减少,故溶液颜色变浅。所以黄绿色的氯水光照后颜色变浅的事实能用勒夏特列原理解释,B项错误;
HCl+HClO平衡向正反应方向移动,溶解的Cl2分子逐渐减少,故溶液颜色变浅。所以黄绿色的氯水光照后颜色变浅的事实能用勒夏特列原理解释,B项错误;
C.SO2转化为SO3:2SO2+O2![]() 2SO3,生成SO3的方向气体体积减小,根据勒夏特列原理,增大压强平衡向气体体积减小的方向移动,所以加压能使SO2更多地转化为SO3的事实能用勒夏特列原理解释,C项错误;
2SO3,生成SO3的方向气体体积减小,根据勒夏特列原理,增大压强平衡向气体体积减小的方向移动,所以加压能使SO2更多地转化为SO3的事实能用勒夏特列原理解释,C项错误;
D.向该溶液中加铁粉时发生反应2Fe3++Fe=3Fe2+,溶液中Fe3+的浓度减小,根据勒夏特列原理,Fe3++SCN-![]() Fe(SCN)2+平衡向逆反应方向移动,红色粒子Fe(SCN)2+浓度减小,溶液颜色变浅或褪去。所以在含有Fe(SCN)2+的红色溶液中加铁粉,溶液颜色变浅或褪去的事实能用勒夏特列原理解释,D项错误;答案选A。
Fe(SCN)2+平衡向逆反应方向移动,红色粒子Fe(SCN)2+浓度减小,溶液颜色变浅或褪去。所以在含有Fe(SCN)2+的红色溶液中加铁粉,溶液颜色变浅或褪去的事实能用勒夏特列原理解释,D项错误;答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度 /g·cm-3 | 沸点 /℃ | 溶解度 /100g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
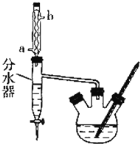
操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3-4滴浓硫酸,投入沸石。安装分水器![]() 作用:实验过程中不断分离除去反应生成的水
作用:实验过程中不断分离除去反应生成的水![]() 、温度计及回流冷凝管。
、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管___(填“a”或“b”)端管口通入;
(2)反应中浓硫酸的作用是___;
(3)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是___;
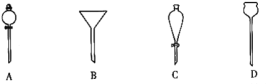
(4)进行分液操作时,使用的漏斗是___(填选项);
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏__(填“高”或“低”),原因__;
(6)该实验过程中,生成乙酸正丁酯的产率是___。