��Ŀ����
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է������� | �ܶ� /g��cm-3 | �е� /�� | �ܽ�� /100gˮ |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |
�������£�
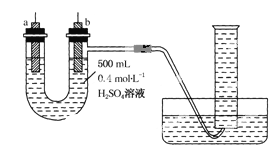
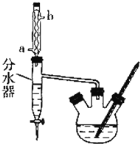
����50mL������ƿ�У�����18.5mL��������13.4mL�����ᣬ3-4��Ũ���ᣬͶ���ʯ����װ��ˮ��![]() ���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ
���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ![]() ���¶ȼƼ����������ܡ�
���¶ȼƼ����������ܡ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10%Na2CO3��Һϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣��õ�15.1g������������
��ش��й����⣺
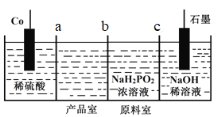
��1����ˮӦ�ô�������___(����a������b��)�˹ܿ�ͨ�룻
��2����Ӧ��Ũ�����������___��
��3�����������10%Na2CO3��Һϴ���л��㣬�ò�����Ŀ����___��
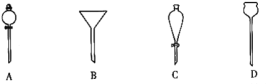
��4�����з�Һ����ʱ��ʹ�õ�©����___(��ѡ��)��
��5��������ڽ����������ʱ������118�濪ʼ�ռ���֣�����ƫ__������������������)��ԭ��__��
��6����ʵ������У����������������IJ�����___��
���𰸡�a ��������ˮ�� ��ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ C �� ���ռ�������δ��Ӧ�ı������������ 65%
��������
(1)��ˮӦ�ô������ܵ��¿ڽ��Ͽڳ�����a�˽����ʴ�Ϊ��a��
(2)������Ӧ�У�Ũ���������������������ˮ�����ʴ�Ϊ����������ˮ����
(3)Na2CO3��Һϴ���л���������dz�ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ���ʴ�Ϊ����ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ��
(4)��Һ�����η�Һ©������C���ʴ�Ϊ��C��
(5)�������ķе�Ϊ118�棬������ķе�Ϊ118.1�棬����118�濪ʼ�ռ�������ռ����϶���������ʹ��ᣬ���²���ƫ�ߣ��ʴ�Ϊ���ߣ����ռ�������δ��Ӧ�ı��������������
(6)������������=0.8g��cm-3��18.5mL=14.8g��n(������)=![]() ��0.2mol�������������=1.045 g��cm-3��13.4mL=14.003g��n(������)=
��0.2mol�������������=1.045 g��cm-3��13.4mL=14.003g��n(������)=![]() ��0.23mol���������������������������������ֵ������CH3COOH+CH3CH2CH2CH2OH
��0.23mol���������������������������������ֵ������CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O��֪�������Ͽɵ�����������0.2mol�������Ͽɵ�����������������Ϊ��0.2mol��116g/mol=23.2g�����ԣ������������IJ���=
CH3COOCH2CH2CH2CH3+H2O��֪�������Ͽɵ�����������0.2mol�������Ͽɵ�����������������Ϊ��0.2mol��116g/mol=23.2g�����ԣ������������IJ���=![]() ��100%=65%���ʴ�Ϊ��65%��
��100%=65%���ʴ�Ϊ��65%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�