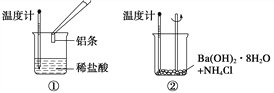
题目内容
【题目】某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
【答案】D
【解析】甲中滴加溴水不褪色,说明溶液中没有还原性的SO32-;乙中滴加酸化的BaCl2溶液,生成2.33g白色沉淀,此沉淀为BaSO4,物质的量为0.01mol,可知含有0.01molSO42-,滤液滴加酸化的AgNO3溶液生成白色沉淀AgCl的质量为2.87g,物质的量为0.02mol,则溶液中不存在Cl-,原因滴加BaCl2溶液生成0.01molBaSO4时引入的Cl-为0.02mol;丙中滴加NaOH溶液有白色沉淀生成,此沉淀为Mg(OH)2,同时无气体生成,说明没有Fe3+、NH4+,0.58gMg(OH)2的物质的量为0.01mol,可知溶液里含有0.01molMg2+恰好与0.01molSO42-组成中性溶液,故原溶液中也不存在Na+、K+;A.有分析可知废水不存在Na+、K+和Fe3+,故A错误;B.不存在Na+、K+,无须通过焰色反应进一步检验确认,故B错误;C.废水一定含有SO42-和Mg2+,不含Cl-,故C错误;D.有分析可知废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+,故D正确;答案为D。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。