题目内容
【题目】氮的化合物是造成大气污染的主要物质,研究有关反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
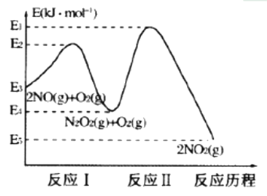
①写出反应I的热化学方程式______________。
②升高温度发现总反应2NO(g)+O2(g)![]() 2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有_______(反应未使用催化剂)。
2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有_______(反应未使用催化剂)。
A 反应I是快反应,反应II是慢反应 B 总反应的速率由反应I决定
C 升高温度平衡I、II均向逆反应方向移动 D 对于反应II,浓度的影响大于温度的影响
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
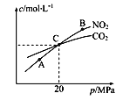
①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是用平衡分压代替平衡浓度计算)
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率如图所示:
,NOx的去除率如图所示:
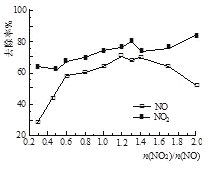 。
。
①![]() 的合适范围是____。
的合适范围是____。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是____ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是____ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a 0.6 b 0.8 c 1.4
【答案】2NO(g)![]() N2O2(g) △H=-(E3-E4)kJ·mol-1 ACD = B点 4Mpa 1.2-1.4 NO2和OH-反应生成NO3-和NO,导致NO去除率降低 a
N2O2(g) △H=-(E3-E4)kJ·mol-1 ACD = B点 4Mpa 1.2-1.4 NO2和OH-反应生成NO3-和NO,导致NO去除率降低 a
【解析】
(1)①根据能量关系图,反应①为NO转化为N2O2,反应物能量高于生成物能量,所以反应①为放热反应,△H=-(E3-E4)kJ/mol;
②A.反应活化能越大,反应速率越慢;
B.总反应由慢反应决定;
C.由图像可知,两个反应均为反应物的总能量大于生成物的总能量,为放热反应,根据温度对平衡移动的影响分析;
D.温度升高后反应I平衡逆向移动,导致N2O4浓度减小,据此分析;
(2)①化学平衡常数K只与温度有关,温度不变,K不变;
②根据压强对化学平衡的影响分析可得;
③已知C点NO2和CO2的物质的量浓度相等,据此列三段式计算平衡时各物质的物质的量,再计算Kp;
(3)①图象读取去除率最高时的![]() 的合适范围;
的合适范围;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
③O3和NO发生的主要反应为:NO+O3=NO2+O2,保持NO的初始浓度不变,改变![]() ,节省O3的用量,又能保持NOx去除效果,需要保持
,节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.2~1.4。
的合适范围是1.2~1.4。
(1)①根据能量关系图,反应I的为放热反应,反应为:2NO(g)![]() N2O2(g)△H=-(E3-E4)kJ·mol-1;
N2O2(g)△H=-(E3-E4)kJ·mol-1;
②A.反应活化能越大,反应速率越慢,根据图像所示,反应I活化能小于反应II的活化能,则反应I是快反应,反应II是慢反应,故A正确;
B.总反应的速率慢反应决定,反应II是慢反应,则由反应II决定,故B错误;
C.由图像可知,两个反应均为反应物的总能量大于生成物的总能量,为放热反应,升高温度,平衡向吸热的方向移动,则平衡I、II均向逆反应方向移动,故C正确;
D.两步反应过程均为放热过程,温度升高后反应I平衡逆向移动,导致N2O4浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,故D正确;
答案选ACD;
(2)①A.B两点的温度相同,平衡常数K只与温度有关,温度不变,K不变,故浓度平衡常数关系:Kc(A)=Kc(B);
②反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g)是个气体体积增大的反应,增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最低的是B点;
N2(g)+2CO2(g)是个气体体积增大的反应,增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最低的是B点;
③1molNO2和足量C发生该反应,设反应转化的二氧化氮的物质的量为x,列三段式:
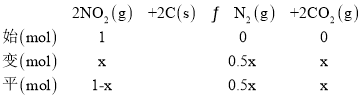
从图知C点时NO2和CO2的物质的量浓度,则1x=x,解得x=0.5,则平衡时总的物质的量为1.25mol,C点时该反应的压强平衡常数Kp(C)=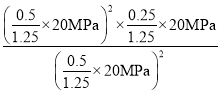 =4MPa;
=4MPa;
(3)①图中曲线变化分析可知, ![]() 的合适范围是1.21.4,在此范围去除率最大;
的合适范围是1.21.4,在此范围去除率最大;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低;
大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低;
③O3和NO发生的主要反应为:NO+O3=NO2+O2,保持NO的初始浓度不变,改变![]() 节省O3的用量,又能保持NOx去除效果,需要保持
节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.21.4,则
的合适范围是1.21.4,则![]() 合适的值约为0.60.7,故答案选a。
合适的值约为0.60.7,故答案选a。

 阳光试卷单元测试卷系列答案
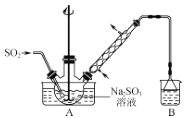
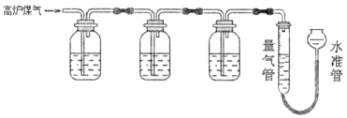
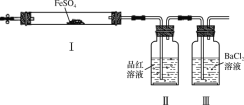
阳光试卷单元测试卷系列答案【题目】经测定乙醇的分子式为C2H6O。由于有机物普遍存在同分异构现象,推测乙醇结构可能是下列两种之一:(I)CH3CH2OH(II)CH3OCH3。为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙三位同学直接利用如图给定的装置进行实验,确定乙醇的结构。
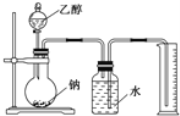
(1)学生甲得到一组实验数据:
乙醇的物质的量(mol) | 氢气的体积(标况)(L) |
0.10 | 1.13 |
0.10 | 1.11 |
0.10 | 1.12 |
0.10 | 1.18 |
请根据上表,帮助甲同学正确处理实验数据,氢气体积的平均值为__(L),由此推断乙醇的结构应为__式(用I或II表示),理由是___。写出乙醇与钠反应的化学方程式:___。
(2)同学乙分别准确称量4.60g乙醇进行多次实验,结果发现以排到量筒内的水的体积,作为生成的H2体积总是小于1.12L(换算成标准状况后)。如果忽略量筒本身及读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?___(填“正确”或“不正确”)。如果不正确,请说明理由:____。
(3)同学丙认为实验成功的关键有:①装置气密性要良好②实验开始前准确确定乙醇的量③钠足量④广口瓶内必须有足量水⑤氢气体积的测算方法正确、数值准确⑥应了解实验时的温度和大气压强。其中正确的有____。(填序号)