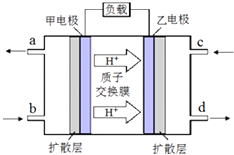
题目内容
【题目】相同物质的量的Na、Fe、Al分别跟足量的稀硫酸反应,生成的气体在同温同压下体积比为
A.1:2:3B.46:56:27C.6:3:2D.1/23:1/28:1/9
【答案】A
【解析】
相同物质的量的镁、铝、铁分别与足量的稀硫酸反应,
2Na~2e-~H2
Fe~2e-~H2
Al~3e-~1.5H2
所以相同物质的量的Na、Fe、Al分别与足量的稀硫酸反应生成相同状况下氢气的体积比=物质的量之比=0.5:1:1.5=1:2:3,A项正确;
答案选A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4) :
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。某同学进行实验,实验装置如图。其中A、B的成分见表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
② | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
③ | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该反应的离子方程式为_____________________________,实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5mol/LH2C2O4/mL | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/S | 40 | 20 | 10 | ______ |
(2) X=______,4号实验中始终没有观察到溶液褪色,你认为可能的原因是________________。
(3)2号反应中,H2C2O4的反应速率为_____________。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/S | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,你得出的结论是_______________________。
(5)从影响化学反应速率的因素看,你的猜想还可能是______________的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_________。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
【题目】已知:CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO 利用如图装置用正丁醇合成正丁醛.相关数据如表:
CH3CH2CH2CHO 利用如图装置用正丁醇合成正丁醛.相关数据如表:
物质 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )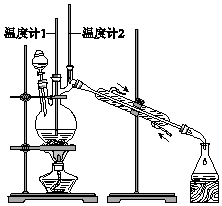
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .