题目内容
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4) :
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。某同学进行实验,实验装置如图。其中A、B的成分见表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
② | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
③ | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该反应的离子方程式为_____________________________,实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5mol/LH2C2O4/mL | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/S | 40 | 20 | 10 | ______ |
(2) X=______,4号实验中始终没有观察到溶液褪色,你认为可能的原因是________________。
(3)2号反应中,H2C2O4的反应速率为_____________。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/S | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,你得出的结论是_______________________。
(5)从影响化学反应速率的因素看,你的猜想还可能是______________的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_________。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
【答案】 5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O 5 H2C2O4的量太少,KMnO4过量 0.00625mol·L-1·s-1 反应速率加快不是温度的影响 催化剂 d
【解析】(1) 该反应为酸性高锰酸钾氧化草酸生成二氧化碳同时生成硫酸锰,反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;(2)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1-4中溶液的总体积应该为20,则X=20-10-5=5;根据反应5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中H2C2O4的量太少,KMnO4过量,导致溶液没有褪色;(3)2号实验中草酸的物质的量为:0.5mol/L×0.01L=0.005mol,高锰酸钾的物质的量为:0.2mol/L×0.005L=0.001mol,
根据反应5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:0.001mol×![]() =0.0025mol,2号反应中,H2C2O4的反应速率为:v(H2C2O4)=
=0.0025mol,2号反应中,H2C2O4的反应速率为:v(H2C2O4)=![]() =0.00625mol/(Ls);(4)从表中数据可知,温度升高不明显,对反应速率影响不大,反应速率加快不是温度的影响;(5) KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可。答案选d。
=0.00625mol/(Ls);(4)从表中数据可知,温度升高不明显,对反应速率影响不大,反应速率加快不是温度的影响;(5) KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可。答案选d。

【题目】马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2 , 还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图: 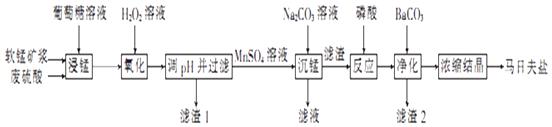
(1)软锰矿要先制成矿浆的目的是 , 葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为 .
(2)用H2O2溶液“氧化”时发生反应的列子方程式为 .
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为 , 滤渣1的主要成分为(填化学式).
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为 .
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐t.
