题目内容
9.请回答:(1)H2O2的电子式
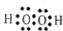 .
.(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式Br-+AgCl?AgBr+Cl-.
(4)完成以下氧化还原反应的离子方程式:
2MnO4-+5 C2O42-+16H+=2Mn2+10 CO2↑+8H2O.
分析 (1)为共价化合物,结构式为H-O-O-H;
(2)镁燃烧不能用CO2灭火,二者反应生成MgO和C;
(3)白色沉淀转化为淡黄色沉淀,发生沉淀的转化,AgCl转化为AgBr;
(4)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,结合电子、电荷及原子守恒配平.
解答 解:(1)为共价化合物,结构式为H-O-O-H,其电子式为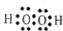 ,故答案为:
,故答案为: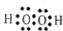 ;
;
(2)镁燃烧不能用CO2灭火,二者反应生成MgO和C,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)白色沉淀转化为淡黄色沉淀,发生沉淀的转化,AgCl转化为AgBr,离子反应为Br-+AgCl?AgBr+Cl-,故答案为:Br-+AgCl?AgBr+Cl-;
(4)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,则由电子守恒可知2MnO4-+5 C2O42-+→2Mn2+10 CO2↑+,由电荷守恒可知2MnO4-+5 C2O42-+16H+→2Mn2+10 CO2↑+,由原子守恒可知2MnO4-+5 C2O42-+16H+=2Mn2+10 CO2↑+8H2O,故答案为:2;5;16H+;2;10;8H2O.
点评 本题考查离子反应方程式的书写及氧化还原反应,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重沉淀转化及氧化还原反应配平的离子反应考查,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
19.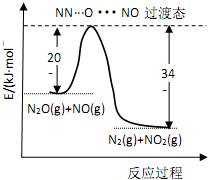 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
17.下列电离方程式正确的是( )
| A. | 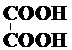 ? ? | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
4.下列实验操作正确的是( )
| A. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| B. | 重结晶法提纯苯甲酸时,为了除去杂质和防止苯甲酸析出,应该趁热过滤 | |
| C. | 配制银氨溶液时,将硝酸银溶液慢慢滴入稀氨水中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| D. | 无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
14.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
15.下列实验操作或者说法正确的是( )
| A. | 把烧杯放在垫有石棉网的铁圈上加热 | |
| B. | 为了不造成浪费,实验剩余的药品放回原瓶 | |
| C. | 用100ml量筒量取8.5ml的水 | |
| D. | 用燃着的酒精灯去点燃另一酒精灯 |

 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.