题目内容
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
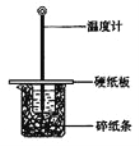
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【答案】(1)环形玻璃搅拌棒
(2)偏小
(3)不相等;相等
(4)偏大; 无影响;
(5)①△H=-56.8kJ/mol;②HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq)△H=-56.8kJ/mol(可写成离子方程式)
(6)AD
【解析】试题分析:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸进行上述实验,测得中和热数值相等;故答案为:不相等;相等;
(4)氨水属于弱碱,电离是需要吸收热量,如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,放出的热量偏少,所求的中和热△H会偏大;KOH属于强电解质,若用KOH代替NaOH,实验所测的热量不变,故答案为:偏大; 无影响;
(5)①2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55molL-1NaOH和50mL.0.5molL-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:△H=-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:△H=-56.8kJ/mol;
②NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l) △H=-56.8kJ/mol,故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol;
(6)A.实验装置保温、隔热效果差,热量散失较大,所得中和热的数值偏小,故A正确;B.量取稀盐酸溶液的体积时仰视读数,会导致所量的稀盐酸体积偏大,放出的热量偏高,则大于57.3kJ/mol,故B错误;C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较少,所得中和热的数值偏大,故C错误;D.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故D正确;故答案为:AD。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
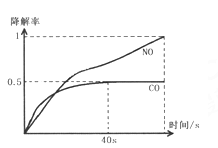
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )____min,原因是_________________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率________________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列__________以减慢反应速率。(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
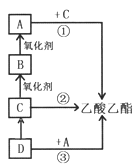
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是________。
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=(转化的物质的量/初始物质的量)×100%】,请写出计算过程,计算结果保留1位小数)________
【题目】人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________。

②提高甲烷反应选择性的关键因素是_______,根据相关知识和图2分析合成甲烷适宜的反应条件是
在550~630K,1MPa的原因是__________________。
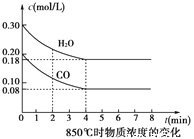
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________。