题目内容
5.醋酸亚铬水合物([Cr(CH3COO)2]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图甲所示,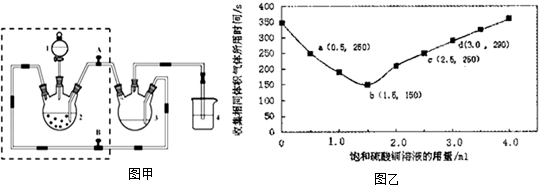
涉及的化学方程式如下:
①Zn(s)+2H2SO4(aq)=ZnSO4(aq)+H2(g)
②2CrCl3(aq)+Zn(s)=2CrCl2(aq)+ZnCl2(aq);
③2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)?[Cr(CH3COO)2]2•2H2O(s).
(1)CrCl3溶液应放在装置装置2中(填写装置编号,下同),醋酸钠溶液应放在装置装置3中.装置4的作用是保持装置压强平衡,同时避免空气进入装置3.
(2)防止Cr2+被氧化,本实验中所有配制溶液的水需煮沸,其原因是去除水中的溶解氧,防止Cr2+被氧化.
(3)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是打开阀门A、关闭阀门B (填“打开”或“关闭”).
(4)本实验中锌粒须过量,其原因是产生足够的H2,与CrCl3充分反应得到CrCl2.
(5)为洗涤[Cr(CH3COO)2]2•2H2O产品,下列方法中最适合的是C.
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(6)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响.实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图乙所示(气体体积均转化为标况下).据图分析,a点和c点对应氢气生成速率是否相等相等(填“相等”或“不相等”); b点对应的反应速率为v ( H2SO4)=1.0×10-3mol•L-1•s-1.
分析 工作原理是:先在装置2中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价.因此在装置2中,我们要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气.反应开始前,应该先打开B让氢气充满整个装置,然后再关闭B,打开A,让装置2中的二价铬离子进入装置3,跟醋酸钠反应生成醋酸亚铬水合物,醋酸钠溶液应放在装置3中,盐酸应放在装置1中,装置4的作用是:可以防止空气进入装置3.
(1)CrCl3溶液应放在装置2中,醋酸钠溶液应放在装置3中,装置4的作用是:可以防止空气进入装置3;
(2)水中溶解的氧气可以氧化Cr2+;
(3)利用氢气的压力将装置2中的溶液压往装置3中进行反应;
(4)本实验中锌粒须过量,其原因是:①产生足够的H2;②与CrCl3充分反应得到CrCl2 ;
(5)洗涤[Cr(CH3COO)2)]2•2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水和乙醚洗涤[Cr(CH3COO)2)]2•2H2O产品;
(6)a、c两点生成等体积的氢气,需要的反应速率相等,所以两点对应的反应速率相等;根据b点生成的反应时间、生成氢气体积计算出消耗硫酸的平均反应速率.
解答 解:工作原理是:先在装置2中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价.因此在装置2中,我们要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气.反应开始前,应该先打开B让氢气充满整个装置,然后再关闭B,打开A,让装置2中的二价铬离子进入装置3,跟醋酸钠反应生成醋酸亚铬水合物,醋酸钠溶液应放在装置3中,盐酸应放在装置1中,装置4的作用是:可以防止空气进入装置3.
(1)依据分析可知,CrCl3溶液应放在装置2中,醋酸钠溶液应放在装置3中,由上述工作原理可知,装置4是保持装置压强平衡,同时避免空气进入装置3,
故答案为:装置2;装置3;保持装置压强平衡,同时避免空气进入装置3;
(2)实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是:二价铬不稳定,极易被氧气氧化,需要去除水中的溶解氧,防止Cr2+被氧化;
故答案为:去除水中的溶解氧,防止Cr2+被氧化;
(3)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开A关闭B,把生成的CrCl2溶液压入装置3中反应,
故答案为:打开;关闭;
(4)锌的作用是和盐酸反应生成氢气,增大仪器中的压强将生成的CrCl2溶液压入装置3,与CrCl3充分反应得到CrCl2,所锌要过量,
故答案为:产生足够的H2;与CrCl3充分反应得到CrCl2;
(5)洗涤[Cr(CH3COO)2)]2•2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,不能用乙醇和盐酸,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸,因此先用水洗去杂质离子,再用乙醚来洗去多余的水,多余的乙醚可以挥发掉,
故答案为:C;
(6)在a、c两点生成等量的氢气,消耗的时间相等,都是250s,根据v=$\frac{△c}{△t}$可知:a、c两点对应的氢气生成速率相等;
标准状况下336mL氢气的物质的量为0.015mol,反应消耗了0.015molH2SO4,硫酸的浓度变化为:△c(H2SO4)=$\frac{0.015mol}{0.1L}$=0.15mol/L,b点对应的平均反应速率为:v(H2SO4)=$\frac{0.15mol}{150s}$=1.0x10-3mol•L-1•s-1,
故答案为:相等;1.0×10-3mol•L -1•s-1.
点评 本题主要考查影响化学反应速率的因素,并结合数据分析CuSO4溶液对化学反应速率的影响等,侧重考查考生运用所学知识灵活作答,根据实验分析问题的思维能力,题目难度中等.

| A. | N4属于一种新型的化合物 | |
| B. | 等质量的N4与N2所含的原子个数比为2:1 | |
| C. | N4与N2的摩尔质量相等 | |
| D. | 等质量的N4与N2所含的原子个数比为1:1 |
物质 组别 | 甲 | 乙 | 丙 |
| A | Cl2 | MgBr2 | NaOH |
| B | SO2 | Ca(OH)2 | NaHCO3 |
| C | SiO2 | NaOH | HF |
| D | NH3 | O2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 | |
| B. | 碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 浓度均为0.1mo1•L-l的氨水和氯化铵溶液,水电离出的c(H+)前者和后者相同 | |
| D. | 等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
| A. | 将饱和FeCl3溶液滴入蒸馏水即可 | |
| B. | 将饱和FeCl3溶液滴入热水中,生成棕黄色液体即可 | |
| C. | 将饱和FeCl3溶液滴入沸水中,并继续煮沸至溶液呈红褐色即可 | |
| D. | 将饱和FeCl3溶液滴入沸水中,并继续煮沸至出现红褐色沉淀即可 |
| A. | v(A)=0.5 mol/(L•min) | B. | v(B)=0.02mol/(L•s) | ||
| C. | v(C)=0.8 mol/(L•min) | D. | v(D)=0.01mol/(L•s) |
| A. | 4g 氦气 | B. | 1.25mol O2 | ||
| C. | 22.4升 Cl2(标准状况) | D. | 6.02×1023个SO2分子 |
 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题: