题目内容
【题目】已知反应![]() 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是
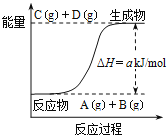
A.该体系的压强不变时标志此反应处于平衡状态
B.若该反应中有电子得失,则可设计成原电池
C.反应物的总键能高于生成物的总键能
D.该反应中的反应物A和B的转化率一定相同
【答案】C
【解析】
A.从图像可知,![]() 反应中A、B、C、D都是气体,反应前后压强始终不变,所以压强不变不能说明反应达到平衡状态,故A错误;
反应中A、B、C、D都是气体,反应前后压强始终不变,所以压强不变不能说明反应达到平衡状态,故A错误;
B.若该反应中有电子得失为氧化还原反应,反应是吸热反应,不一定能自发进行,非自发进行的氧化还原反应不能设计为原电池,故B错误;
C.图象分析可知,反应物能量低于生成物,反应为吸热反应,当反应物的总键能高于生成物的总键能反应的焓变为正值,反应为吸热反应,符合图象变化,故C正确;
D.反应物A和B的转化率和起始量有关,若起始量不同,转化率也不同,故D错误。
答案:C。

练习册系列答案
相关题目







