题目内容
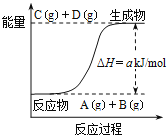
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
A.C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH3 S(l)+O2(g)=SO2(g) ΔH4
C. 2H2(g)+O2(g)=2H2O(l) ΔH5 H2(g)+![]() O2(g)=H2O(l) ΔH6
O2(g)=H2O(l) ΔH6
D.CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
【答案】D
【解析】
A、完全燃烧产生的热量大于不完全燃烧产生的热量,ΔH前者小于后者;
B、相同质量的物质,气态含有的能量高于固体的,因此前者放出的能量多,ΔH前者小于后者;
C、物质状态相同时,物质反应的越多,放出的热量就越多,ΔH前者小于后者;
D、前者是吸热反应,后者是放热反应,所以ΔH前者大于后者;
答案选D。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4mol | 2mol | ||
CO | 2mol | 1mol | ||
CH3OH(g) | 0 | 0.7mol |
①下列各项能作为判断该反应达到平衡标志的是____________(填字母);
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=_________ (kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=__________kPamin-1。