题目内容
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
【答案】A
【解析】
A.水分子间存在范德华力和氢键,冰融化时,需要破坏晶体中的范德华力和氢键,冰融化时密度变小,故A错误;
B.对于分子晶体来说,熔沸点高低取决于分子间的作用力范德华力,一般来说,对于组成和结构相似的分子,随分子量的增大,分子间力增大,其熔沸点升高,故B正确;
C.石墨晶体中层与层之间相隔340pm,距离较大,是以范德华力结合起来的,即层与层之间属于分子晶体,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向,故C正确;
D.金属内部有自由电子,当有外加电压时电子定向移动,因此金属可以导电,故D正确。
故选A。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
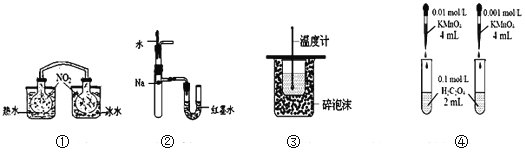
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂A应为_______ 。
(2)写出实验③中I-反应的离子方程式___________。
(3)对比实验②③④,可以得出的结论是__________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2。
ii.pH>9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
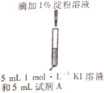
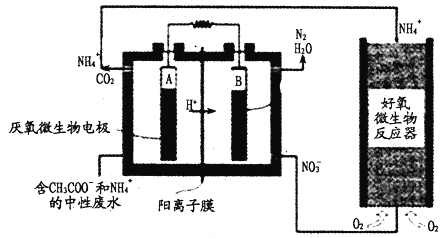
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示:
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是________(填序号)。
A.既发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B.既发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C.发生了氧化反应,但没有发生歧化反应
D.发生了歧化反应,但没有发生氧化反应
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈___形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为![]()
![]() 该同学所画的电子排布图违背了____。
该同学所画的电子排布图违背了____。
(3)G位于______族______区,价电子排布式为______。
(4)检验F元素的实验方法是_________。