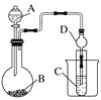
��Ŀ����
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�ⷴӦ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H1=-53.7kJ��mol-1 I
CH3OH(g)+H2O(g) ��H1=-53.7kJ��mol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H2 II
CO(g)+H2O(g) ��H2 II
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ-283.0kJ��mol-1��-285.8kJ��mol-1
��H2O��l��![]() H2O��g����H3=44.0kJ��mol-1
H2O��g����H3=44.0kJ��mol-1
�������¶ȶ���H��Ӱ�죬��
��1����ӦI��ƽ�ⳣ������ʽK=_____________����ӦII����H2=________kJ��mol-1��
��2�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��Ӧ��2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ��S(s)+O2(g)![]() SO2(g) ��H3=��297 kJ��mol��1
SO2(g) ��H3=��297 kJ��mol��1
��Ӧ����Ȼ�ѧ����ʽ��_____________________��
���𰸡�![]() +41.2 3SO2(g)+2H2O (g)=2H2SO4 (l)+S(s) ��H2=254 kJ��mol1
+41.2 3SO2(g)+2H2O (g)=2H2SO4 (l)+S(s) ��H2=254 kJ��mol1
��������
��1����ӦI��ƽ�ⳣ������ʽK=![]() ����֪:CO��
����֪:CO��![]() �ı�ȼ���ȷֱ�Ϊ-283.0kJ��mol-1��-285.8kJ��mol-1��H2O��l��
�ı�ȼ���ȷֱ�Ϊ-283.0kJ��mol-1��-285.8kJ��mol-1��H2O��l��![]() H2O��g����H3=44.0kJ��mol-1��
H2O��g����H3=44.0kJ��mol-1��
����֪���Ȼ�ѧ����ʽ
a.![]()
![]() ��
��
b.![]()
![]() ��
��
c.![]() ��
��
�ɸ�˹���ɽ�b-a+c�ɵ�:![]()
![]() ��
��
��2�����ݸ�˹���ɣ�![]() ��
��![]() ����ˣ���Ӧ�����Ȼ�ѧ����ʽΪ
����ˣ���Ӧ�����Ȼ�ѧ����ʽΪ![]() ��
��

 С�����ϵ�д�
С�����ϵ�д�����Ŀ��һ���¶��£���2L�ܱ������з������з�Ӧ��4NO2(g)+O2(g)![]() 2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300����K350��������ϵ��n(NO2)(��λ��mol)��ʱ��仯���±���
2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300����K350��������ϵ��n(NO2)(��λ��mol)��ʱ��仯���±���
ʱ��(s) | 0 | 500 | 1000 | 1500 |
t1�� | 20 | 13.96 | 10.08 | 10.08 |
t2�� | 20 | a | b | c |
����˵��һ����ȷ����
A. ����ӦΪ���ȷ�Ӧ
B. ���t2�棼t1�棬��ôa��b=c����a=10+0.5b
C. ���t2�棼t1�棬��ôt2��ﵽƽ���ʱ�����1000s��1500s֮��
D. ���t2�棾t1�棬��ôb��10.08
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M������6������ |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ����������ǣ�7�� |
W | �䵥�ʼ��ܸ��ᷴӦ�����ܸ�ǿ�Ӧ��������H2 |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ�����_____��
��2��Ԫ��Y����Ԫ���γ�һ������YH4����д�������ĵ���ʽ_____����μ���ij��Һ�к�������_____��
��3��Ԫ��Z�����ڱ��е�λ��_____��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ����_____����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����_____������ţ���
a.������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b.Z���⻯���T���⻯���ȶ�
c.һ�������£�Z��T�ĵ��ʶ���������������Һ��Ӧ