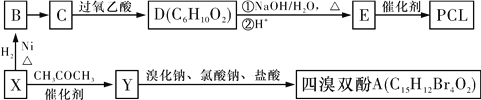
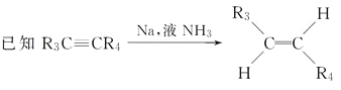
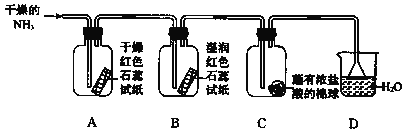
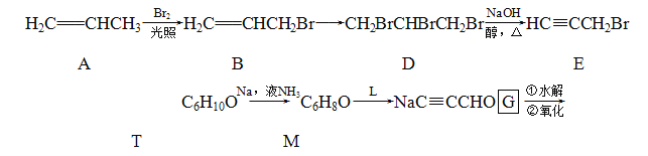题目内容
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是____(填元素符号,下同),第一电离能最小的是____;
(2)C所在的主族元素气态氢化物中,沸点最低的是____(填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为______;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是____(填选项序号);
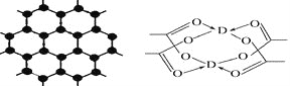
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:_____________。
【答案】ClCuHClsp2①②③[Cu(NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
【解析】
A原子核是一个质子,即A为H,B原子核外电子有6种不同的运动状态,说明B原子核外有6个电子,即B为C,C和F或Cl形成正四面体形,因为四种元素分别位于不同周期,因此C为Cl,根据D的外围电子排布式,推出D为Cu,(1)非金属性越强,其电负性越大,四种元素中非金属性最强的是Cl,即电负性最强的元素为Cl,第一电离能最小,说明金属性越强,非金属性越弱,因此第一电离能最强的元素是Cu;(2)Cl位于第VIIA族,HF分子间存在氢键,其余不含分子间氢键,即HF沸点最高,相对分子质量越大,分子晶体的沸点越高,另外三种卤族氢化物中HCl的分子量最小,即HCl沸点最低;(3)根据图示,该碳原子有3个σ键,无孤电子对,因此C的杂化类型为sp2;(4)由结构图可知该醋酸铜晶体中含有极性键、非极性键和配位键,故①②③正确;(5)分析实验流程图可知:Cu与Cl2反应生成CuCl2,蓝色沉淀为Cu(OH)2,蓝色溶液为[Cu(NH3)4]Cl2,黑色沉淀则为CuS。据此可写出离子方程式为: [Cu(NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案