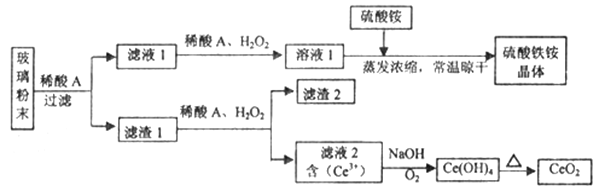
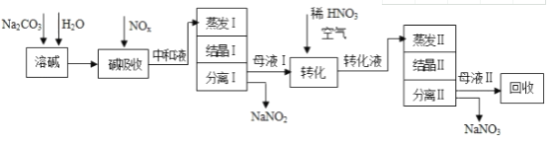
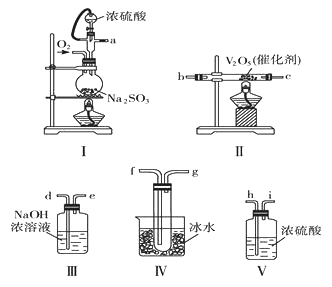
题目内容
【题目】下列指定反应的离子方程式正确的是
A. 用铁电极包解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO3-+H2O
C. 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+
D. 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
【答案】C
【解析】
A. 用铁电极包解饱和食盐水,阳极是铁失去电子生成Fe2+,故A错误;B. 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO2+H2O,故B错误;C. 因硫化铜的Ksp特别小,向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+,故C正确;D. 向Al2(SO4)3溶液中加入过量氨水生成氢氧化铝沉淀,故D错误。答案选C。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、量筒、________、________。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1 NaOH溶液
C.1.0 g NaOH固体
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/ kJ·mol-1 |
A.1.0 mol/L HCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | ΔH1 | |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | ΔH2 |
①甲在实验之前预计ΔH1=ΔH2。他的根据是__________________________________;乙在实验之前预计ΔH1≠ΔH2,他的根据是__________________________________。
②实验测得的温度是:A的起始温度为13.0 ℃、终了温度为19.8 ℃;B的起始温度为13.0 ℃、终了温度为19.3 ℃。设充分反应后溶液的比热容c=4.184 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1=________;ΔH2=________。(已知溶液密度均为1 g/cm3)