��Ŀ����
����Ŀ����ҵ�����ð�������õĸ�Ũ��NOx���壨��NO��NO2���Ʊ�NaNO2��NaNO3�������������£�
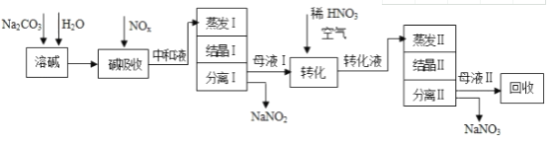
��֪��Na2CO3+NO+NO2�T2NaNO2+CO2
��1���к�Һ�������ʳ�NaNO2������Na2CO3�⣬����_________________���ѧʽ����
��2���к�Һ�������������ʱ��Ӧ����ˮ��������������Ũ�ȹ���Ŀ����_____________������������������к���������NaNO2���ж����ʣ�����ֱ���ŷţ��������������������е�_____________________����������ƣ��������
��3��ĸҺ�����ת��ʱ����ϡHNO3��Ŀ����______________________________��ĸҺ����������ã����д���������������_______��
a��ת���к�Һ b��ת��ᾧ����� c��ת��ת��Һ d��ת��ᾧ�����
��4������NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮����Ϊ2��1��������1.38��NaNO2ʱ��Na2CO3����������Ϊ______________�֣��ٶ�Na2CO3ǡ����ȫ��Ӧ����
���𰸡�NaNO3��ֹNaNO2�������ܼNaNO2ת��ΪNaNO3cd1.59
��������
���Ʊ����̿�֪��̼�����ܽ�����շ���Na2CO3+NO+NO2�T2NaNO2+CO2��3NO2+H2O=HNO3+NO��Na2CO3+2HNO3=NaNO3+H2O+CO2����Ȼ���к�Һ���������������Ӧ����Ũ�ȹ���NaNO2����������������������к���������NaNO2���ж�����Ҫ������ѭ�����ã��ᾧ���˷����NaNO3��ĸҺI����Ҫ��NaNO2��ĸҺ�����ת��ʱ����ϡHNO3�������������ṩ���Ի������ɽ�NaNO2ת��ΪNaNO3��ת��Һ�������ᾧ�����˷����NaNO3��ĸҺ������Ҫ��NaNO3��Ӧ��ת��Һ���ᾧ����������ʣ��Դ˽��1������3������4������1.38��NaNO2ʱ��n��NaNO2��=![]() =2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3�������m=nM������
=2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3�������m=nM������
���Ʊ����̿�֪��̼�����ܽ�����շ���Na2CO3+NO+NO2�T2NaNO2+CO2��3NO2+H2O=HNO3+NO��Na2CO3+2HNO3=NaNO3+H2O+CO2����Ȼ���к�Һ���������������Ӧ����Ũ�ȹ���NaNO2����������������������к���������NaNO2���ж�����Ҫ������ѭ�����ã��ᾧ���˷����NaNO3��ĸҺI����Ҫ��NaNO2��ĸҺ�����ת��ʱ����ϡHNO3�������������ṩ���Ի������ɽ�NaNO2ת��ΪNaNO3��ת��Һ�������ᾧ�����˷����NaNO3��ĸҺ������Ҫ��NaNO3��Ӧ��ת��Һ���ᾧ���������������1��������������֪�������������Һ��Ӧ����NaNO2����������NaNO3���к�Һ�к�ʣ�������Na2CO3���ʴ�Ϊ��NaNO3����2���к�Һ�������������ʱ��Ӧ����ˮ��������������Ũ�ȹ���Ŀ���Ƿ�ֹNaNO2������������������������к���������NaNO2���ж����ʣ�����ֱ���ŷţ��������������������е��ܼѭ�����ã���������ʣ���3��������������֪��ĸҺ�����ת��ʱ����ϡHNO3��Ŀ���ǽ�NaNO2ת��ΪNaNO3��ĸҺ����������ã���ת��ת��Һ��ת��ᾧ�����������������ʣ��ʴ�Ϊ����NaNO2ת��ΪNaNO3��cd����4������1.38��NaNO2ʱ��n��NaNO2��=![]() =2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3����m��Na2CO3��=��2��104mol+1��104mol����
=2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3����m��Na2CO3��=��2��104mol+1��104mol����![]() ��106g/mol=1.59��106g=1.59t��
��106g/mol=1.59��106g=1.59t��

����Ŀ��ijѧϰС�����ӹ�ҵ�Ϸ������л���V2O5��ͨ������֪�÷Ϸ���������Ҫ�ɷ����±�:
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2��29 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | <1 |
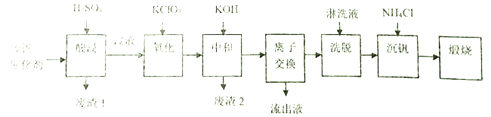
����ͨ�����������ҵ�һ�ַϷ������Ļ��չ�������·������:
�ش���������:
��1���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+����������1������Ҫ�ɷ���_____________��
��2������������Ŀ����ʹVO2+��ΪVO2+��д���÷�Ӧ�����ӷ���ʽ________________________��
��3�����к�������֮һ��ʹ����V4O124-��ʽ��������Һ�У���������2���ijɷ���__________(�û�ѧʽ��ʾ)��
��4�������ӽ���������ϴ�����ɼ�ʾΪ:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
��5�����������õ�ƫ�����(NH4VO3)������д���õ������Ļ�ѧ����ʽ__________________��

