题目内容
【题目】在一定条作下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
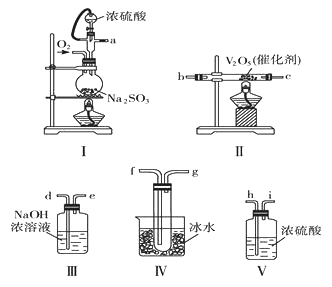
请根据要求回答问题:
(1)各装置接口的连接顺序是a→_________________。
(2)装置Ⅳ烧杯中盛放冰水的作用是_____________________。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是_________________。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是_______。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__________________。
【答案】h→i→b→c→f→g→d→e 使SO3冷凝以便从气相中分离出来 硫酸浓度过大时主要以分子形式存在,反应较慢;硫酸浓度过小时生成的SO2会部分溶解在稀硫酸中 将装置中的SO2全部赶入装置II中发生反应,将SO3全部赶入装置IV中冷凝为固体 ![]() ×100%
×100%
【解析】
(1)Ⅰ是制备二氧化硫的,Ⅱ是氧化二氧化硫的,IV是收集三氧化硫,III是吸收尾气的,为测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。(2)由于SO3的熔点为16.83℃,沸点是448℃,所以装置Ⅳ烧杯中盛放冰水的作用是使SO3冷凝以便从气相中分离出来;(3)由于硫酸浓度过大时主要以分子形式存在,反应较慢;硫酸浓度过小时生成的SO2会部分溶解在稀硫酸中,故制备二氧化硫气体时常用一般选用浓度为70%~80%的硫酸与亚硫酸钠固体加热反应; (4)当装置Ⅰ中反应结束时,继续通入O2一段时间,目的是将装置中的SO2全部转移到装置II中发生反应,将SO3全部转移到装置IV中冷凝为固体,提高测量SO2转化率的准确性;(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,由硫元素守恒可知,SO2的转化率==bg/80g/mol÷(ag/126g/mol)=63b/40a×100%。

【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
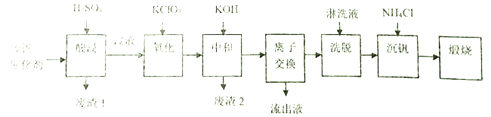
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。