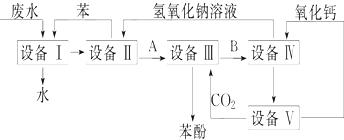
题目内容
【题目】某铁的氧化物,用7mol/L的盐酸100mL在一定条件下恰好完全溶解,所得溶液再通入0.56L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+ . 则该氧化物的化学式可表示为( )
A.FeO
B.Fe3O4
C.Fe4O5
D.Fe5O7
【答案】D
【解析】解:设二价铁离子的物质的量为xmol,三价铁离子的物质的量为ymol,由某铁的氧化物,用7.0mol/L的盐酸100mL在一定条件下恰好完全溶解,
依据电荷守恒可知最终溶液中溶质为氯化亚铁和氯化铁,依据电荷守恒可知二价铁离子和三价铁离子带的正电荷总数等于氯离子带电负电荷总数,即:2x+3y=0.1L×7.0mol/L=0.7mol;
溶液中只有二价铁离子能与氯气发生反应生成三价铁离子,氯气被还原为氯离子,依据氧化还原反应中得失电子守恒规律可知二价铁失去的电子总数等于氯气得到的电子总数,即:x×1= ![]() ×2=0.05mol;
×2=0.05mol;
解得:x=0.05mol;y=0.2mol;
所以该氧化物中Fe(+2价)与Fe(+3价)的物质的量分别为0.05mol、0.2mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)= ![]() ×n(HCl)=
×n(HCl)= ![]() ×0.7mol=0.35mol,所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,
×0.7mol=0.35mol,所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,
该氧化物的化学式为Fe5O7 ,
故选D.

【题目】某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成.学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分. 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 molL﹣1盐酸、2molL﹣1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式. 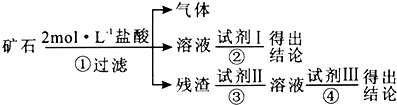
试剂Ⅰ;试剂Ⅱ;试剂Ⅲ .
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
编号 | 实验操作 | 预期现象和结论 |
① | 取适量矿石研细,加 | 有大量无色气体生成,得棕黄 |
② | ||
③ | ||
④ |