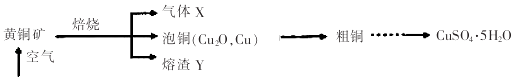��Ŀ����
����Ŀ��ij��ѧ��ȤС��ij�Ա��һ���ʯ���۲���۷��ָÿ�ʯ��Ӳ�ҳʺ��ɫ��Ͷ��ˮ��û���κα仯������ˮ�м�Ũ��������������ʯ�����ܽ⣬���д�����ɫ�������ɣ�ѧ���²�ÿ�ʯ������CaCO3��SiO2��Fe2O3���ֳɷ���ɣ������ʵ��֤��CaCO3��������ֳɷ֣� ����ѡ����������Լ����ձ����Թܡ����������ιܡ�ҩ�ס�©����©���ܣ�2 molL��1���ᡢ2molL��1NaOH��Һ��2%��KSCN��Һ��
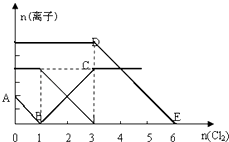
��1����ʵ�鷽������������ʾ��ͼ��ʾ����д��ÿ�������Լ������ƻ�ѧʽ�� 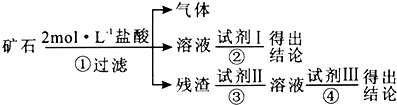
�Լ������Լ������Լ��� ��
��2������²��dz����ģ��Ը�������ʵ�鷽��������ʵ�������Ԥ������ͽ��ۣ�
��� | ʵ����� | Ԥ������ͽ��� |
�� | ȡ������ʯ��ϸ���� | �д�����ɫ�������ɣ����ػ� |
�� | ||
�� | ||
�� |
���𰸡�
��1��2%��KSCN��Һ��2mol?L��1NaOH��Һ��2mol?L��1����
��2��ȡ�ٲ�������Һ�������ڽྻ�Թ��У����μӼ���2%��KSCN��Һ����Һ��Ϊ��ɫ��˵��ԭ��ʯ���ܺ���Fe2O3��ȡ�ٲ����ò���������������ձ��У���������2 mol?L��1NaOH��Һ����ֽ��裻���������ȫ�ܽ���2 mol?L��1NaOH��Һ��������ɫ��Һ��ȡ�۲�������ɫ��Һ�������ڽྻ�Թ��У��ý�ͷ�ιܵ���2 mol?L��1�������������а�ɫ��״�������Ҳ����ڹ������ᣬ˵��ԭ��ʯ�п��ܺ���SiO2
���������⣺��1��Fe2O3���������ᣬFe3+��������Һ�У�����SCN�����飬�Ӷ�˵����ʯ��Fe2O3 �� SiO2���������ᣬ��Ϊ�������˳���Ϊ��һ��ȷ�ϣ��Ƿ����SiO2 �� ����NaOH��Һ����ַ�Ӧ���ټ����ᣬ��������˰�ɫ��״��������ΪH2SiO3 �� ˵����ʯ����SiO2 �� ���Դ��ǣ�2%��KSCN��Һ��2 molL��1 NaOH��Һ��2 molL��1�����2�������ʯ�к���Fe2O3 �� �����ᷴӦ�����Ȼ�����ȡ�������������еĢ���2%KSCN��Һ����Һ��ΪѪ��ɫ��������������
�����Ƿ��ж������裬ȡ�ٲ����ò���������������ձ��У���������2 molL��1NaOH��Һ����ֽ��裬���������ȫ�ܽ���2 molL��1NaOH��Һ��������ɫ��Һ��
Ȼ��ȡ�۲�������ɫ��Һ�������ڽྻ�Թ��У��ý�ͷ�ιܵ���2 molL��1�������������а�ɫ��״�������Ҳ����ڹ������ᣬ��˵�����ж������裬
���Դ��ǣ�
�� | ȡ�ٲ�������Һ�������ڽྻ�Թ��У����μӼ���2%��KSCN��Һ | ��Һ��Ϊ��ɫ��˵��ԭ��ʯ���ܺ���Fe2O3 |
�� | ȡ�ٲ����ò���������������ձ��У���������2 molL��1NaOH��Һ����ֽ��� | ���������ȫ�ܽ���2 molL��1NaOH��Һ��������ɫ��Һ |
�� | ȡ�۲�������ɫ��Һ�������ڽྻ�Թ��У��ý�ͷ�ιܵ���2 molL��1���������� | �а�ɫ��״�������Ҳ����ڹ������ᣬ˵��ԭ��ʯ�п��ܺ���SiO2 |

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������ѡ�õij����Լ���ʵ���������ȷ���ǣ�������Ϊ���ʣ��� ��
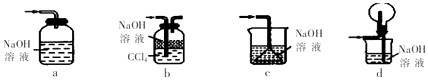
���� | �����Լ�(������ | �������� | |
A | CO2(HC1) | ����������Һ | ����ͨ��ʢ������������Һ��ϴ��ƿ |
B | K2CO3(KCl) | ϡ���� | ����ϡ���ᡢ�������ᾧ |
C | FeSO4(CuSO4) | ���� | �������۲����� |
D | Zn(Fe) | ϡ���� | ����ϡ���ᣬ���� |
A. A B. B C. C D. D