题目内容
【题目】铬和铜都是人体所必需的微量元素。回答下列问题:
(1)铬原子的最高能层符号是_______,其价层电子的轨道表达式(电子排布图)为_______。
(2) 比较第二电离能Cu______Zn(填“>”、“=”、“<"),理由是_________。
(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,已知该氧化物中铬为+6价,请写出CrO5的结构式___________。
(4)氧化亚铜溶于浓氨水中形成无色配离子[Cu(NH3)2]+,则该配离子中铜的化合价为________,杂化类型为_________。[Cu(NH3)2]2SO4中阴离子的立体构型是_________。
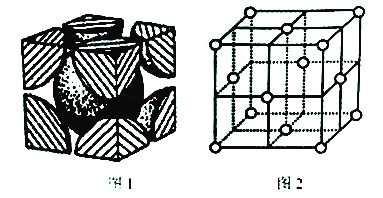
(5)已知图1为铬的晶胞结构图,则铬晶胞属于______堆积,晶跑中实际拥有的铬原子数为_______;图2是铜的晶胞结构图,若其立方晶胞参数为a nm,该晶胞中原子的体积占晶胞体积的百分率为_______。
【答案】 N  > 测试第二电离能时铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10
> 测试第二电离能时铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10 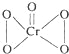 +1 sp 正四面体 体心立方 略 74%(或
+1 sp 正四面体 体心立方 略 74%(或 ![]() 或
或![]()
![]() 或
或 )
)
【解析】试题分析:(1)铬原子的有4个电子层,第四层能量最高;其价层电子的电子排布式是3d54s1;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10;(3)该氧化物中铬为+6价,说明Cr与O原子写成6个共价键;(4)根据[Cu(NH3)2]+中NH3的化合价为0计算铜的化合价;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中;SO42-中S原子的价电子对数是![]() ,无孤对电子;(5)根据铬的晶胞结构图,晶胞顶点、体心各有1个铬原子;根据均摊原则计算晶跑中实际拥有的铬原子数;根据晶胞边长计算铜原子的体积,根据均摊原则计算晶跑中实际拥有的铜原子数,铜原子实际体积
,无孤对电子;(5)根据铬的晶胞结构图,晶胞顶点、体心各有1个铬原子;根据均摊原则计算晶跑中实际拥有的铬原子数;根据晶胞边长计算铜原子的体积,根据均摊原则计算晶跑中实际拥有的铜原子数,铜原子实际体积![]() 晶胞的体积即晶跑中原子的体积占晶胞体积的百分率;
晶胞的体积即晶跑中原子的体积占晶胞体积的百分率;
解析:(1)铬原子的有4个电子层,第四层能量最高,最高能层符号是N;其价层电子的电子排布式是3d54s1,轨道表达式(电子排布图)为![]() ;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,所以第二电离能Cu>Zn;(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,该氧化物中铬为+6价,说明Cr与O原子写成6个共价键, CrO5的结构式是
;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,所以第二电离能Cu>Zn;(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,该氧化物中铬为+6价,说明Cr与O原子写成6个共价键, CrO5的结构式是 ;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中,杂化类型为sp;SO42-中S原子的价电子对数是
;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中,杂化类型为sp;SO42-中S原子的价电子对数是![]() ,无孤对电子,所以立体构型是正四面体;(5)已知图1为铬的晶胞结构图,晶胞顶点、体心各有1个铬原子,属于体心立方堆积;根据均摊原则计算晶跑中实际拥有的铬原子数
,无孤对电子,所以立体构型是正四面体;(5)已知图1为铬的晶胞结构图,晶胞顶点、体心各有1个铬原子,属于体心立方堆积;根据均摊原则计算晶跑中实际拥有的铬原子数![]() ;晶胞参数为a nm,晶胞的体积为
;晶胞参数为a nm,晶胞的体积为![]() ,则铜原子的半径是
,则铜原子的半径是![]() ,根据均摊原则晶跑中实际拥有的铜原子数
,根据均摊原则晶跑中实际拥有的铜原子数![]() ,铜原子的体积是
,铜原子的体积是 ,晶胞中原子的体积占晶胞体积的百分率为
,晶胞中原子的体积占晶胞体积的百分率为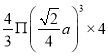
![]()
![]() =
=![]() 。
。

 全程金卷系列答案
全程金卷系列答案【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:

①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。