题目内容
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
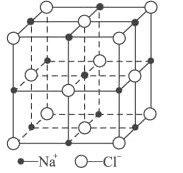
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
【答案】 1s22s22p63s23p63d64s2 N Fe 直线形 sp3 NH3﹥AsH3﹥PH3 NH3之间形成了氢键,分子间作用力大,所以沸点高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高 离子键、配位键、共价键或(离子键、配位键、σ键、π键) ![]()
【解析】(1)铁的原子序数为26,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;元素Fe和N中,N的其态原子的电子排布式为1s22s22p3,最外层电子受到核的吸引力大于铁,第一电离能较大的是N,根据二者的电子排布可知,基态原子核外未成对电子数分别为4和3,较多的是铁,故答案为:1s22s22p63s23p63d64s2;N;Fe;
(2)N2O与CO2互为等电子体,结构相似,因此N2O的空间构型为直线形,故答案为:直线形;
(3)N2H4中N原子与3个原子相连,含有1个孤电子对,价层电子对数=3+1=4,采用sp3杂化,故答案为:sp3;
(4)NH3分子间能够形成氢键,沸点最高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高,PH3、AsH3三种物质的沸点由高到低的顺序为NH3﹥AsH3﹥PH3,故答案为:NH3﹥AsH3﹥PH3;NH3之间形成了氢键,分子间作用力大,所以沸点高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高;
(5)K3[Fe(CN)6]中存在离子键、极性共价键、配位键,故答案为:离子键、共价键、配位键;
(6)FeO晶体的晶胞与NaCl的相似,在FeO晶体的晶胞中含有Fe原子或O原子的数目均为4,某氧化亚铁晶体的实际组成为Fe0.9O,则1个晶胞的质量=![]() g,因此该晶体的密度=
g,因此该晶体的密度=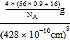 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。







