题目内容
【题目】Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为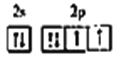 ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,该能级含有的轨道数为________
(2)W的元素名称为_____,其基态原子的电子排布式为________
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y、Z 形成的化合物B 是等电子体物质,A、B分子式分别为______、_______。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____(用元素符号作答),原因是______________________________
【答案】 .6 2p 3 铜元素 [Ar]3d104s1 O3 SO2 N 非金属性越强,第一电离能越大,但由于N原子2p轨道电子半充满为稳定结构,比O原子更难失去电子,N原子的第一电离能最大
【解析】Q原子的最外层电子数是次外层电子数的2倍,即Q为C,根据Y的价电子排布图,推出Y为O,Y和Z属于同主族,则Z为S,W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,即W为Cu,原子序数依次增大,则X为N,(1)考查电子运动状态、能级、原子轨道,Q为C,核外有6个电子,即核外有6种运动状态不同的电子,电子占据的最高能级符号是2p,p能级有3个原子轨道;(2)考查电子排布式的书写,W为铜元素,电子排布式为 [Ar]3d104s1或1s22s22p63s23p63d104s1;(3)考查等电子体,五种元素种电负性最强的元素是O,O形成的单质为O2、O3,Y和Z形成的化合物是SO2、SO3,O3和SO2互为等电子体,因此A为O3,B为SO2;(4)同周期从左向右,第一电离能增大,但IIA>IIIA,VA>VIA,因此有N>O>C,原因是:非金属性越强,第一电离能越大,但由于N原子2p轨道电子半充满为稳定结构,比O原子更难失去电子,N原子的第一电离能最大。

 阅读快车系列答案
阅读快车系列答案