题目内容
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备 Mg3N2 并进行有关实验。实验装置如下所示: (部分加热装置已略去)
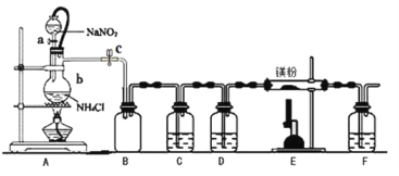
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器 b 的名称是__________,写出装置 A 中发生反应的化学方程式___________。
(2)某同学检验装置 A 部分的气密性,关闭止水夹 c 后,开启活塞 a,水不断往下滴,直至全部流入烧瓶。试判断:
A 部分装置是否漏气? ________ (填“漏气”、“不漏气”或“无法确定”),判断理由是____________。
(3)装置 C 中为饱和硫酸亚铁溶液, 其作用是___________,装置 F 的作用是________。
(4)加热至反应开始发生,需移走 A 处酒精灯,原因是__________________。
(5)定性分析产物
操作步骤 | 实验现象 | 解释原因 |
取少量产品于试管中, 加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | 反应的化学方程式为 __________________________________ |
弃去上层淸液, 加入足量稀盐酸 | 观察到固体全部溶解, 且有气泡冒出 | 气泡冒出的原因为___________________________________________________ |
【答案】 蒸馏烧瓶 NH4Cl+NaNO2![]() N2 ↑+NaCl+2H2O 无法确定 由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶 除去氧气以免与镁反应 防止空气中的水蒸气进入E装置使氮化镁水解 该反应剧烈放热,产生氮气的速度快,移走A处酒精灯能避免反应物冲出,同时避免温度过高,造成NaNO2分解产生O2 Mg3N2+6H2O=3Mg(OH)2 +2NH3 未反应的镁与盐酸反应产生氢气
N2 ↑+NaCl+2H2O 无法确定 由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶 除去氧气以免与镁反应 防止空气中的水蒸气进入E装置使氮化镁水解 该反应剧烈放热,产生氮气的速度快,移走A处酒精灯能避免反应物冲出,同时避免温度过高,造成NaNO2分解产生O2 Mg3N2+6H2O=3Mg(OH)2 +2NH3 未反应的镁与盐酸反应产生氢气
【解析】(1)仪器 b 的名称是蒸馏烧瓶,因带有支管;A装置中发生反应的化学方程式为NH4Cl+ NaNO2 ![]() N2↑+NaCl+2H2O
N2↑+NaCl+2H2O
(2)由于分液漏斗和蒸馏烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体流入烧瓶中,所以无法确定装置A是否漏气;
(3)当加热温度过高时,导致NaNO2分解产生氧气,会影响氮气与镁的反应,所以装置C中饱和硫酸亚铁溶液的作用是除去可能产生的氧气,防止氧气与镁反应;由于氮化镁极易与水反应,所以装置F的作用是防止空气中的水蒸气进入装置E中使氮化镁水解;
(4)因为亚硝酸钠和氯化铵的反应剧烈放热,产生氮气的速率快,所以加热至反应开始发生,即移走A处酒精灯,避免反应物冲出,使N2气流保持平稳,同时也避免温度过高,造成NaNO2分解产生O2;
(5)Mg3N2极易与水反应,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3;产品加水反应后的固体中含有Mg(OH)2,可能有未反应的镁,所以加入盐酸后二者都能反应,且镁与盐酸反应能产生氢气。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案