题目内容
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
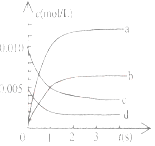
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
【答案】K=c2(NO2)/[c2(NO).c(O2)]Cb0.0015mol/(L.s)BC
【解析】
:(1)可逆反应2NO(g)+ O2(g)![]() 2NO2(g)的平衡常数K=c2(NO2)/[c2(NO).c(O2)],根据已知 K300℃>K350℃,说明升高温度平衡向逆反应移动,故正反应是放热反应△H <0,又因为反应后气体变少,所以△S<0;因此C符合题意。答案是: K=c2(NO2)/[c2(NO).c(O2)] C;
2NO2(g)的平衡常数K=c2(NO2)/[c2(NO).c(O2)],根据已知 K300℃>K350℃,说明升高温度平衡向逆反应移动,故正反应是放热反应△H <0,又因为反应后气体变少,所以△S<0;因此C符合题意。答案是: K=c2(NO2)/[c2(NO).c(O2)] C;
(2)由方程式2NO(g)+ O2(g)![]() 2NO2(g)和图像可以知道,平衡时浓度的变化量△c(NO) : △c(O):△c(NO2)=2:1:2,由表中数据可以知道,平衡时△c(NO)=(0.02mol-0.007mol)/2L=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,
2NO2(g)和图像可以知道,平衡时浓度的变化量△c(NO) : △c(O):△c(NO2)=2:1:2,由表中数据可以知道,平衡时△c(NO)=(0.02mol-0.007mol)/2L=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,
由图中数据可以知2s内NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)= 0.006mol.L-1 /2s=0.003mol/(L.s) ,根据速率之比等于化学计量数之比,故v(O2)=1/2 v(NO)=1/2![]() =0.0015mol/(L.s),因此,本题答案是:b; 0.0015mol/(L.s)。
=0.0015mol/(L.s),因此,本题答案是:b; 0.0015mol/(L.s)。
(3)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故A错误;B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,所以B选项是正确的;C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆 (NO)=2v正 (O2),说明到达平衡,而v (NO)=2v(O2)不能说明到达平衡,所以C选项是错误的;D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故D错误;所以B选项是正确的。
(4)因为2NO(g)+O2(g)![]() 2NO2(g) K300℃>K350℃,所以正反应是放热反应适当升高温度,反应速率增大,平衡向逆反应移动,故A不符合题意;B.选择高效的催化剂,增大反应速率,不影响平衡移动,故B不符合题意;C.增大O2的浓度,反应速率增大,平衡向正反应移动,所以C选项正确; D.充入He(g),使体系总压强增大,但不影响分压,平衡混合物中各组分的浓度保持不变,故平衡不移动,D不符合题意;所以答案为C。
2NO2(g) K300℃>K350℃,所以正反应是放热反应适当升高温度,反应速率增大,平衡向逆反应移动,故A不符合题意;B.选择高效的催化剂,增大反应速率,不影响平衡移动,故B不符合题意;C.增大O2的浓度,反应速率增大,平衡向正反应移动,所以C选项正确; D.充入He(g),使体系总压强增大,但不影响分压,平衡混合物中各组分的浓度保持不变,故平衡不移动,D不符合题意;所以答案为C。

【题目】某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:

(1)0~8 min,v(CO2)=__________mol·L-1·min-1。
(2)该反应在恒温恒容的密闭容器中进行,能说明该反应达到化学平衡状态的是_____
A、单位时间内 ,每消耗1molCO2同时生成1molCO
B、容器内气体的压强不再随时间变化
C、容器内气体的密度不再随时间变化
D、容器内气体的平均相对分子质量不再随时间变化
(3)计算该温度下,反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数__________
FeO(s)+CO(g)的平衡常数__________
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填序号)。
A、温度 B、铁粉的量(足量) C、压强 D、CO的量
(5)已知:反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
②根据表中数据,计算反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。


