题目内容
【题目】能源问题是人类社会面临的重大问题,合理的开发利用至关重要。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
![]()
则△H=_______
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g)![]() CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
该反应速率的通式为v正=k正cm(CO).cn(H2)(k是与温度有关的速率常数)。由表中数据可确定反应速率通式中m和n分别_____、_____( 取正整数)。
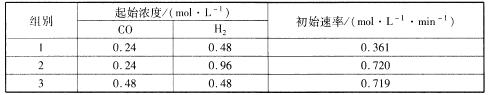
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g) ![]() CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
①p1____p2(填“<”“>”或“=")。
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为______;该温度下的平衡常数K=_______mol2·L-2。
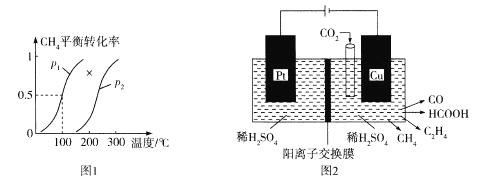
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:_____________;如果Cu电极上生成0.17molCO和0.33molHCOOH,则Pt电极上产生O2的物质的量为__________mol。
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为______(用含a、b的代数式表示)。
【答案】+125kJ/mol 1 1 < 0.003 mol/(L·min) 1.35×10-4 2CO2+12H++12e-===C2H4+4H2O 0.25 ![]()
【解析】
(1)焓变=反应物键能-生成物键能,据此计算;
(2)将表格数据代入公式,利用待定系数法求解;
(3)①该反应为压强增大的反应,同温度下压强越大甲烷的转化率越低;
②根据![]() 计算反应速率甲烷的速率,再推算用氢气表示的反应速率;K等于生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值;
计算反应速率甲烷的速率,再推算用氢气表示的反应速率;K等于生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值;
(4)①铜电极为阴极,得电子发生还原反应;根据电路中电子守恒进行计算;
②HCOOH的电离常数K=![]() ,据此进行计算。
,据此进行计算。
(1)△H =反应物键能-生成物键能=(10×414kJ/mol+3×348kJ/mol)-(8×414kJ/mol+2×348kJ/mol+615kJ/mol+436kJ/mol)=+125kJ/mol,故答案为:+125kJ/mol;
(2)v正=k正cm(CO)·cn(H2)可知①中0.361mol/(L·min)= k正×(0.24mol/L)m×(0.48mol/L)n;②中:0.720mol/(L·min)= k正×(0.24mol/L)m×(0.96mol/L)n;③中:0.719mol/(L·min)= k正×(0.48mol/L)m×(0.48mol/L)n;则②/①可得2=2n,即n=1;③/①得2=2m,则m=1,故答案为:1;1;
(3)①该反应为压强增大的反应,同温度下压强越大甲烷的转化率越低,所以p1<p2,故答案为:<;
②据图可知压强为P1,温度为100°C时,反应达到平衡时甲烷的转化率为50%,所以平衡时c(CH4)=![]() =0.005mol/L,所以v(CH4)=
=0.005mol/L,所以v(CH4)=![]() =0.001 mol/(L·min),v(H2)=3 v(CH4)=0.003 mol/(L·min),
=0.001 mol/(L·min),v(H2)=3 v(CH4)=0.003 mol/(L·min),
平衡时c(CH4)=0.005mol/L,反应了甲烷0.5mol,根据反应方程式CH4(g) + H2O(g) ![]() CO(g) +3H2(g)可知平衡时c(H2O)=
CO(g) +3H2(g)可知平衡时c(H2O)=![]() =0.025mol/L,c(CO)= c(CH4)=0.005mol/L,c(H2)= 3c(CH4)=0.015mol/L,所以平衡常数K=
=0.025mol/L,c(CO)= c(CH4)=0.005mol/L,c(H2)= 3c(CH4)=0.015mol/L,所以平衡常数K=![]() =1.35×10-4mol-2·L-2,故答案为:0.003 mol/(L·min);1.35×10-4;
=1.35×10-4mol-2·L-2,故答案为:0.003 mol/(L·min);1.35×10-4;
(4)①铜电极与电源负极相连为阴极,CO2得电子被还原生成C2H4,根据电荷守恒元素守恒可知电极反应方程式为:2CO2+12H++12e-===C2H4+4H2O;CO和HCOOH中碳均为+2价,CO2转化成CO或HCOOH化合价均降低2价,所以生成0.17molCO和0.33molHCOOH时转移的电子为1mol,则生成的氧气为0.25mol,故答案为:2CO2+12H++12e-===C2H4+4H2O;0.25;
②混合后溶液呈中性,所以c(H+)= c(OH-)=10-7mol/L,根据电荷可知c(HCOO-)=c(Na+)=![]() ,根据物料守恒有:c(HCOO-)+ c(HCOOH)=
,根据物料守恒有:c(HCOO-)+ c(HCOOH)=![]() ,所以c
,所以c![]() ,电离平衡常数K=
,电离平衡常数K= ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案
