题目内容
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
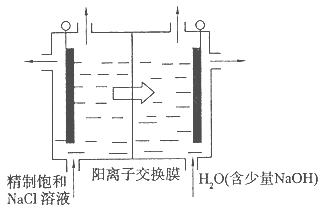
Ⅱ.采用如下装置进行电化学浸出实验
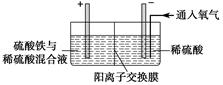
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)
 R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
(1)①吸收硫化氢气体,防止环境污染
②Fe2+-e-=Fe3+
(2)2H++2e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O
(3)分液漏斗 富集Cu2+、分离Cu2+与其它金属阳离子
(4)增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)??R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生
(5)c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
②Fe2+-e-=Fe3+
(2)2H++2e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O
(3)分液漏斗 富集Cu2+、分离Cu2+与其它金属阳离子
(4)增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)??R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生
(5)c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
(1)根据2Fe3++H2S=2Fe2++S↓+2H+,可判断Fe2(SO4)3的主要作用是氧化H2S气体,防止H2S对环境的污染,当Fe3+被H2S还原为Fe2+后,在阳极上Fe2+-e-=Fe3+,使Fe3+的浓度基本保持不变。
(2)在阴极上,2H++2e-=H2↑,然后Cu2++2e-=Cu,接着在酸性条件下,Cu被O2氧化成CuO,CuO和H2SO4反应生成CuSO4。
(3)有机相和水相不混溶,所以应用分液漏斗分离,由于Cu2+在有机相中,所以加入有机萃取剂可富集Cu2+。
(4)利用化学平衡移动原理解释。
(5)2CuSO4+2H2O 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
0.05 mol 0.05 mol
所以n(H+)=0.1 mol
由于Cu2+的水解,所以n(Cu2+)<0.05 mol,n(H+)>0.1 mol。
所以c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
(2)在阴极上,2H++2e-=H2↑,然后Cu2++2e-=Cu,接着在酸性条件下,Cu被O2氧化成CuO,CuO和H2SO4反应生成CuSO4。
(3)有机相和水相不混溶,所以应用分液漏斗分离,由于Cu2+在有机相中,所以加入有机萃取剂可富集Cu2+。
(4)利用化学平衡移动原理解释。
(5)2CuSO4+2H2O
 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑0.05 mol 0.05 mol
所以n(H+)=0.1 mol
由于Cu2+的水解,所以n(Cu2+)<0.05 mol,n(H+)>0.1 mol。
所以c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目