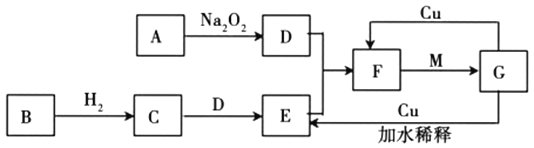
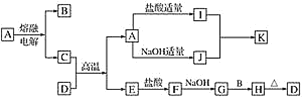
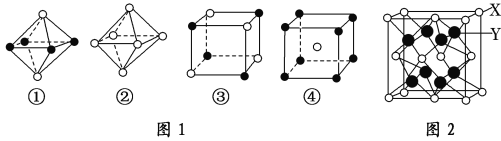
题目内容
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
A.ΔH的数值不再变化B.容器内的压强不再变化
C.气体的颜色不再变化D.气体的密度保持不变
【答案】C
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.对某一反应,△H的数值不变,故A项错误;
B.两边气体计量数相等,容器内压强始终保持不变,故B项错误;
C.气体的颜色不再变化,说明二氧化氮的浓度不变,反应达平衡状态,故C项正确;
D.恒容密闭容器中气体的质量与体积不变,则密度始终一直不变,故D项错误。
故答案为C。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大