题目内容
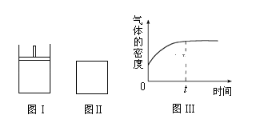
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
【答案】B
【解析】
A. 设X的变化量为2x
2X(?)+ Y(?) aZ(g)
起始量 2mol 2mol 0
变化量 2x mol x mol ax mol
平衡量 (2-2x) mol (2-x)mol ax mol
依题意得 (2-2x) : (2-x) : ax = 1:3:2
从而求得:x=0.8mol a=1
故物质Z的化学计量数a=1,错误;
B. 若Ⅱ中气体的密度如图Ⅲ所示,分析图中信息可以发现,在 “0”点,气体密度不为0,说明X、Y中至少有一种为气态;从“0”点到“t”点,气体的密度增大,若X、Y都为气体,则气体的密度不变,与图中信息不符,所以X、Y中只有一种为气态,B正确;
C. Ⅱ为恒容容器,Ⅰ为恒压容器,若X、Y均为气态,则Ⅰ相当于Ⅱ加压,平衡正向移动, X的转化率增大,故有Ⅰ>Ⅱ,C错误;
D. 若X为固态、Y为气态,则反应前后气体分子数相等,平衡时Ⅰ、Ⅱ的体积相同,气体的压强相同,从开始到平衡所需的时间:Ⅰ=Ⅱ,D错误。
故答案为B。

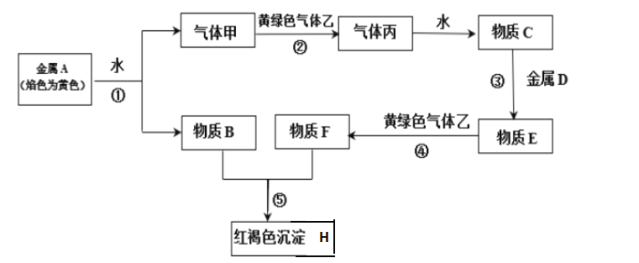
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。