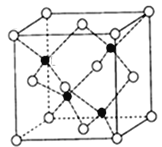
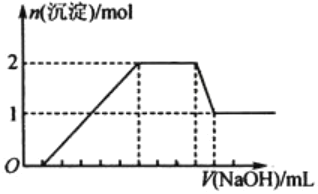
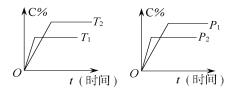
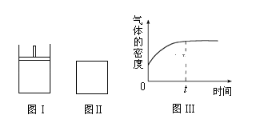
题目内容
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
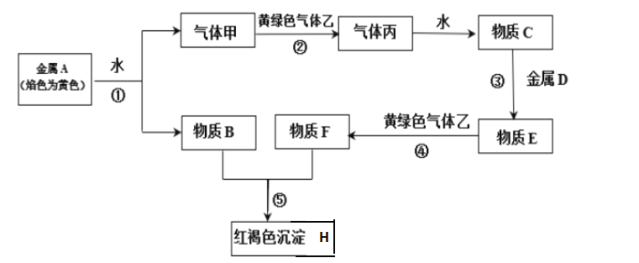
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
【答案】Na NaOH HCl FeCl3 Fe(OH)3 Cl2 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH=Fe(OH)3↓ 0.05
【解析】
根据转化关系分析可知,金属A的焰色为黄色,所以A为Na,A与水生成气体甲(H2)和物质B(NaOH),气体甲和黄绿色气体乙(Cl2)反应生成气体丙(HCl),丙溶于水形成物质C盐酸;因为金属D最终会和氢氧化钠生成红褐色沉淀H,所以D为Fe,物质E为氯化亚铁,物质F为氯化铁,红褐色沉淀H为氢氧化铁,据此分些解答。
(1)根据上述分析,A为Na,B为NaOH,C为HCl,F为FeCl3,H为Fe(OH)3,乙为Cl2,故答案为:Na;NaOH;HCl;FeCl3;Fe(OH)3;Cl2;
(2)反应④为氯化亚铁被氯气氧化成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,反应⑤为氯化铁和氢氧化钠反应生成氢氧化铁,反应的离子方程式为Fe3++3OH=Fe(OH)3↓,故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3OH=Fe(OH)3↓;
(3)金属Fe与稀硫酸反应的化学反应方程式为Fe+H2SO4===FeSO4+H2↑,标准状况下1.12LH2的物质的量为![]() ,则产生标准状况下1.12L(0.05mol)的H2,参加反应的硫酸为0.05mol,故答案为:0.05。
,则产生标准状况下1.12L(0.05mol)的H2,参加反应的硫酸为0.05mol,故答案为:0.05。

【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
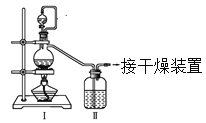
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
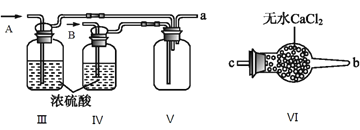
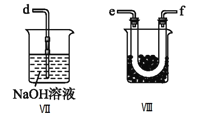
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。