题目内容
【题目】已知乙烯能发生以下转化
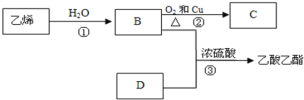
(1)乙烯的结构简式为:__________
(2)写出D化合物中官能团:________;
(3)写出下列反应的化学方程式并注明反应类型。
①______________________,反应类型:______________
②_______________________,反应类型:______________
③______________________,反应类型:______________
【答案】CH2 =CH2 羧基 CH2 =CH2 + H2O![]() CH3CH2OH 加成反应 2CH3CH2OH+O 2
CH3CH2OH 加成反应 2CH3CH2OH+O 2![]() 2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH
2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应或取代反应
CH3COOCH2CH3+H2O 酯化反应或取代反应
【解析】
乙烯结构中有碳碳双键,可以和水发生加成反应生成乙醇(B),乙醇发生催化氧化反应后生成乙醛(C),乙醇和乙酸(D)可以发生酯化反应生成乙酸乙酯,在反应中醇脱去羟基上的氢原子,羧酸脱去羧基上的羟基生成水,据此分析解答此题。
由分析可知,B为乙醇,C为乙醛,D为乙酸。
(1)乙烯分子中的2个C原子之间形成2对共用电子对,每个C原子再与2个H原子形成2对共用电子对,其结构简式为CH2 =CH2;
(2)乙醇和乙酸D发生反应生成乙酸乙酯和水,所以化合物D为乙酸,结构简式为CH3COOH,官能团的名称为羧基;
(3)①乙烯与水发生加成反应生成乙醇,反应的化学方程式是CH2 =CH2 + H2O![]() CH3CH2OH ;
CH3CH2OH ;
②乙醇与O2在Cu或Ag作催化剂时发生氧化反应生成乙醛和水,反应的化学方程式是2CH3CH2OH+O 2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
③乙醇与乙酸在浓硫酸存在时,在加热条件下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式是:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,酯化反应也属于取代反应。
CH3COOCH2CH3+H2O,酯化反应也属于取代反应。

【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
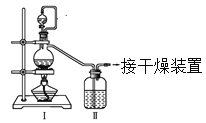
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
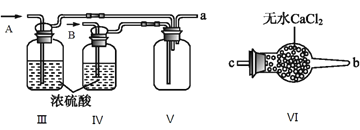
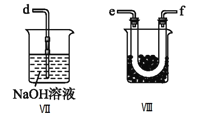
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
【题目】下列实验方案不能达到相应目的的是
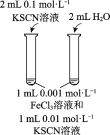
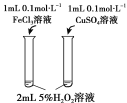
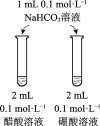
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D