题目内容
【题目】下列图示与对应的叙述相符的是


A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,甲的压强比乙的压强大
3C(g)+D(s)的影响,甲的压强比乙的压强大
C.图3表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
【答案】D
【解析】
A、图象表示的是反应物能量高于生成物能量,反应是放热反应,A错误;
B、该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡向正反应方向移动,则反应物的含量减少,该图中改变条件后,反应物的含量不变,说明平衡不移动,加入的是催化剂,且乙加入了催化剂,B错误;
C、A与B的溶解度随温度的升高而增大,t1℃时A的溶解度大于B的溶解度,所以A的饱和溶液中溶质的质量分数大于B,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶液中溶质和溶剂的质量没有变化,所以质量分数不变,仍然A大于B,C错误;
D、稀释起始时溶液pH相同,稀释HA酸溶液pH变化大,HA的酸性比HB强,越弱越水解,所以NaA的水解程度小于NaB,NaA与NaB水解显碱性,因此NaA溶液的pH小于同浓度的NaB溶液的pH,D正确.
答案选D。

【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
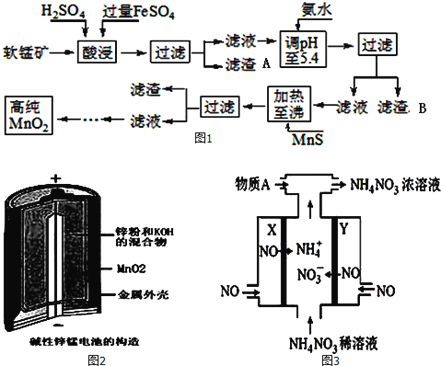
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;