题目内容
7.由CO、H2和O2组成的混合气体60mL.在一定条件下恰好完全反应,测得生成物在101kPa,120℃下对氮气的相对密度为1.262,则原混合气体中H2的体积分数约为( )| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
分析 CO、H2和O2组成的混合气体在一定条件下恰好完全反应,生成CO2和H2O,在101kPa,120℃下对氮气的相对密度为1.262,则混合气体的平均相对分子质量为1.262×28=35.34,根据平均相对分子质量可计算CO2与H2O的物质的量的比值,进而计算原混合气体中H2所占的体积分数.
解答 解:CO、H2和O2组成的混合气体在一定条件下恰好完全反应,生成CO2和H2O,在101kPa,120℃下对空气的相对密度为
1.293,则混合气体的平均相对分子质量为1.262×28=35.34,
设CO2的物质的量为xmol,H2O的物质的量为ymol,
混合气体平均摩尔质量=$\frac{44x+18y}{x+y}$g/mol=35.34g/mol
x:y=2:1,
根据C、H、O 元素质量守恒,得到,反应物中,CO、H2、O2的体积比分别为4:2:3,
则原混合气体中H2所占的体积分数=$\frac{2}{4+2+3}$=$\frac{2}{9}$,故选A.
点评 本题考查混合物的有关计算,为高频考点,明确相同条件下气体摩尔质量与密度关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
17.下列物质中,属于天然高分子化合物的是( )
| A. | 塑料 | B. | 合成纤维 | C. | 蛋白质 | D. | 合成橡胶 |
18.下列物质存放方法错误的是( )
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
2.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,两种溶液中各种粒子的物质的量浓度的关系中(R表示S元素或C元素),一定正确的是( )
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
12.如图为中学化学实验中的常见实验装置
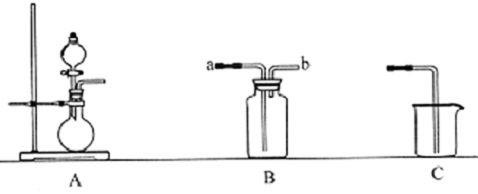
(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
(2)装置B收集多种气体,若要用于收集氨气.则进气管为b(填字母):
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).

(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
| 气体 | O2 | CO2 | NH3 |
| 试剂 |
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).
| 装置 | 离子方程式 |
19.能正确表示下列反应的离子方程式是( )
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
16.某有机物的结构为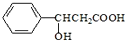 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 既能跟NaOH溶液反应,又能与金属钠反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为:C9H11O3 | |
| D. | 不能发生取代反应 |
17.将下列物质分别注入水,振荡后静置,能分层且浮于水面的是( )
①溴苯 ②乙酸乙酯 ③乙醇 ④甘油 ⑤油酸甘油酯 ⑥硝基苯.
①溴苯 ②乙酸乙酯 ③乙醇 ④甘油 ⑤油酸甘油酯 ⑥硝基苯.
| A. | 全部 | B. | ①②⑤⑥ | C. | ②⑤ | D. | ①⑥ |
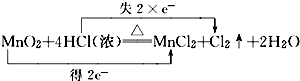 ,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol