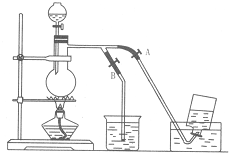
题目内容
10.由Na、Mg、Al、Zn四种金属单质中的两种组成的混合物共12克,跟足量盐酸反应,产生5.6LH2(标况),由此可判断混合物中必定含有( )| A. | Na | B. | Mg | C. | Al | D. | Zn |
分析 标况下5.6L氢气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,设金属都是+2价金属,则金属的平均摩尔质量为:$\frac{12g}{0.25mol}$=48g/mol,即:金属的平均摩尔质量必须为48g/mol,Na为+2价时的摩尔质量为:23g/mol×2=46g/mol,Al为+3价时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol,据此对各选项进行判断即可.
解答 解:标况下5.6L氢气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,设金属都是+2价金属,则金属的平均摩尔质量为:$\frac{12g}{0.25mol}$=48g/mol,即:金属的平均摩尔质量必须为48g/mol,
A.Na为+2价时的摩尔质量为:23g/mol×2=46g/mol;
B.Mg为+2价金属,其摩尔质量为24g/mol;
C.Al为+3价时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol;
D.Zn为+2价金属,其摩尔质量为65g/mol;
根据以上分析可知,Na、Mg、Al+2价时摩尔质量都比平均摩尔质量小,只有Zn的摩尔质量大于48g/mol,所以混合金属中一定含有Zn,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均摩尔质量在化学计算中的应用方法为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
18.下列物质存放方法错误的是( )
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
5.下列反应的离子方程式书写正确的是( )
| A. | 用醋酸去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯化铝与足量氨水反应:Al3++3NH3•H2O═3NH4++Al(OH)3↓ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 稀硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
2.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,两种溶液中各种粒子的物质的量浓度的关系中(R表示S元素或C元素),一定正确的是( )
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
19.能正确表示下列反应的离子方程式是( )
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
20.X、Y、Z、M、W 为五种短周期元素.X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的质子数是 X、Y、Z、M 四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 由 M 与其它元素形成的 1:1 型化合物一定是共价化合物 | |
| B. | XZ2 分子中含有非极性共价键 | |
| C. | 原子半径:W>Z>Y>X>M | |
| D. | 工业上常用电解法制备 W 的单质 |

 ,反应类型是加聚反应;
,反应类型是加聚反应; ,其核磁共振氢谱的峰面积比是1:2(或2:1);
,其核磁共振氢谱的峰面积比是1:2(或2:1); 和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是
和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是 .
.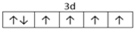 ,
,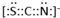 .F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA
.F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA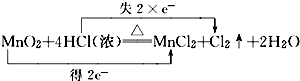 ,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol