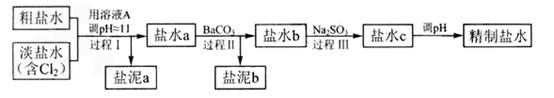
题目内容
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: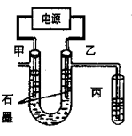
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
(1)Cu2++2e-=Cu
(2)Cl2+2KI=2KCl+I2
(3)A 随着电解的时行,Cl-不断消耗,CuCl42-转化为Cu(H2O)42+
(4)2.2×10(8-2a)
(5)5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
(2)Cl2+2KI=2KCl+I2
(3)A 随着电解的时行,Cl-不断消耗,CuCl42-转化为Cu(H2O)42+
(4)2.2×10(8-2a)
(5)5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
(1)甲为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu;
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,反应的方程式为
Cl2+2KI=2KCl+I2;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色;
(4)Ksp=c2(OH-)×c(Cu2+),c(Cu2+)=2.2×10?20/(10a-14)2=2.2×10(8-2a)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,说明氯气和碘继续发生氧化还原反应,反应的离子方程式为5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,反应的方程式为
Cl2+2KI=2KCl+I2;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色;
(4)Ksp=c2(OH-)×c(Cu2+),c(Cu2+)=2.2×10?20/(10a-14)2=2.2×10(8-2a)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,说明氯气和碘继续发生氧化还原反应,反应的离子方程式为5Cl2+I2+6H2O=10Cl-+2IO3-+12H+

练习册系列答案
相关题目
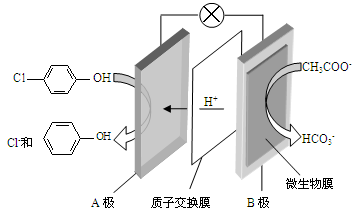
 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。