题目内容
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: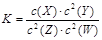 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
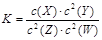 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.该反应可表示为X(g) + 2Y(g) 2Z(g) + 2W(g) 2Z(g) + 2W(g) |
| B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小 |
| C.增大反应容器的压强,该反应速率一定增大 |
| D.升高温度,W(g)体积分数增加,则正反应是放热反应 |
D
试题分析:A.由于化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数乘积的比。所以该反应可表示为2Z(g) + 2W(g)
 X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。
X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。
练习册系列答案
相关题目
 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是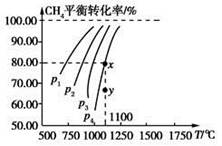
 H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。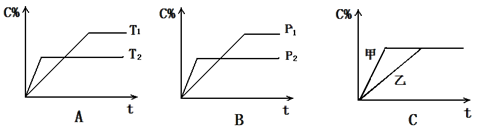
 N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
 CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是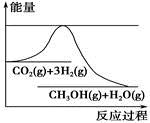
 2B(g)和2A(g)
2B(g)和2A(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是