题目内容
【题目】下图中,B、D、E、F、G是氧化物且B为红棕色固体,F、K是氢化物且F为常温常压下常见无色液体,C、H是日常生活中最常见的金属单质,J是黄绿色气体。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。

请按要求回答:
(1)写出G、L的化学式G:_____________________,L:______________________
(2)反应②的离子方程式 ________________________________________________。
(3)写出反应M→L的离子方程式为________________________________________。
(4)若将O敞口久置,变质过程中的现象为___________________________________
发生的化学方程式为__________________________________________________。
【答案】 Al2O3 FeCl3 SO2+Cl2+2H2O=4H++SO42-+2Cl- 2Fe2++Cl2=2Fe3++2Cl- 白色变灰绿色变红褐色 4Fe(OH)2+O2+2H2O=4 Fe(OH)3
【解析】黄绿色气态单质J为![]() ,C、H是日常生活中常见的金属单质,且C与氧化物B在高温条件下反应得到H与氧化物G,应是铝热反应,C为Al、H为Fe,G是
,C、H是日常生活中常见的金属单质,且C与氧化物B在高温条件下反应得到H与氧化物G,应是铝热反应,C为Al、H为Fe,G是![]() ,H与氯气反应得到L为
,H与氯气反应得到L为![]() ,M与氨水反应生成的O是白色沉淀,且B、H、L、M、N、O中含有同种元素,证明O是
,M与氨水反应生成的O是白色沉淀,且B、H、L、M、N、O中含有同种元素,证明O是![]() ,N为
,N为![]() ,N加热分解生成B为
,N加热分解生成B为![]() 是氢化物,与
是氢化物,与![]() 反应得到M,可推知K为HCl、M为
反应得到M,可推知K为HCl、M为![]() ,由
,由![]() ,可以知道氧化物D具有还原性,I是基础化学工业的重要产品,可推知I是
,可以知道氧化物D具有还原性,I是基础化学工业的重要产品,可推知I是![]() ,D为
,D为![]() ,F为
,F为![]() ;E与水反应也得到硫酸,故E为
;E与水反应也得到硫酸,故E为![]() ,综上分析A应是硫酸亚铁晶体,
,综上分析A应是硫酸亚铁晶体,
(1)根据上述分析知G为Al2O3 L为FeCl3,答案:Al2O3 FeCl3。
(2)根据上述分析知D为![]() , J为
, J为![]() ,F为
,F为![]() ,反应②的离子方程式:
,反应②的离子方程式:
SO2+Cl2+2H2O=4H++SO42-+2Cl-。
(3)由L为![]() ,J为
,J为![]() M+J→L,知M为Fe2+,反应M→L的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
M+J→L,知M为Fe2+,反应M→L的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
(4) 根据上述分析知O是![]() 很不稳定,在空气中会被氧气氧化易变质生成
很不稳定,在空气中会被氧气氧化易变质生成![]() ,其现象为:白色变灰绿色变红褐色。反应方程式为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3。本题答案:4Fe(OH)2+O2+2H2O=4 Fe(OH)3。
,其现象为:白色变灰绿色变红褐色。反应方程式为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3。本题答案:4Fe(OH)2+O2+2H2O=4 Fe(OH)3。

【题目】有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2E | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。

![]()
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
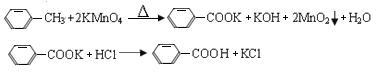
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如下:
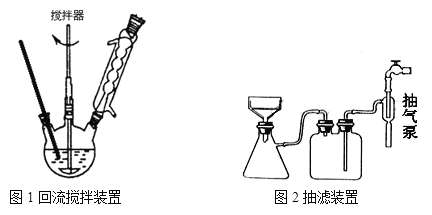
实验方法:一定量的甲苯和KMnO4溶液里于图l 装置中,在90℃时,反应一段时间后,
停止反应,按如下流程分离出苯甲酸并回收未反应的甲苯。
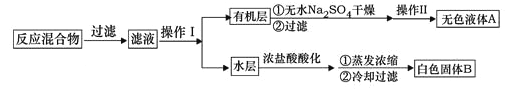
(1)白色固体B中主要成分的分子式为________。操作Ⅱ为________。
(2)如果滤液呈紫色,需加入亚硫酸氢钾,用离子方程式表示其原因__________。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图 回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(4)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(5)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL 溶液,进行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为_______。
