题目内容
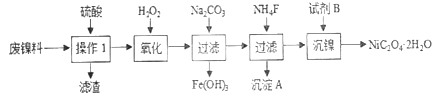
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
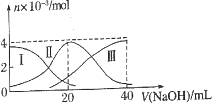
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
【答案】B
【解析】A由图知发生反应为:H2A +NaOH=NaHA+H2O, NaHA+ NaOH=Na2A+H2O, Ⅰ线表示表示n(H2A)的物质的量变化关系,故A错;B. 当![]() 时,反应式为
时,反应式为![]() ,反应后混合溶液的溶质主要为
,反应后混合溶液的溶质主要为![]() ,但由于
,但由于![]() 的水解与电离,所以
的水解与电离,所以![]() ,由曲线Ⅲ高于线Ⅰ可以看出,此时电离强于水解因此
,由曲线Ⅲ高于线Ⅰ可以看出,此时电离强于水解因此![]() ,所以有c(H+)>c(OH-),故B项正确;由图像知 NaHA溶液中的电离程度大于水解程度,所以NaHA溶液中无法确知c(H+)>c(OH-),故正确; C. 当V(NaOH)=20mL时发生反应为:H2A +NaOH=NaHA+H2O, 当V(NaOH)=21mL时有部分发生NaHA+ NaOH=Na2A+H2O,所以c(Na+)>c(HA-)>C c(A2),故C错;D. 当V(NaOH)=40mL时发生反应:H2A + 2NaOH = Na2A + 2H2O因为A2+的水解,根据物料守恒,使得 c(Na+)>2c(A2+),故D错误。
,所以有c(H+)>c(OH-),故B项正确;由图像知 NaHA溶液中的电离程度大于水解程度,所以NaHA溶液中无法确知c(H+)>c(OH-),故正确; C. 当V(NaOH)=20mL时发生反应为:H2A +NaOH=NaHA+H2O, 当V(NaOH)=21mL时有部分发生NaHA+ NaOH=Na2A+H2O,所以c(Na+)>c(HA-)>C c(A2),故C错;D. 当V(NaOH)=40mL时发生反应:H2A + 2NaOH = Na2A + 2H2O因为A2+的水解,根据物料守恒,使得 c(Na+)>2c(A2+),故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目