题目内容
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相 中经自由基偶联反应生成乙烯,其反应如下:2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=_____________ (用含a.b.c.d的代数式表示)。
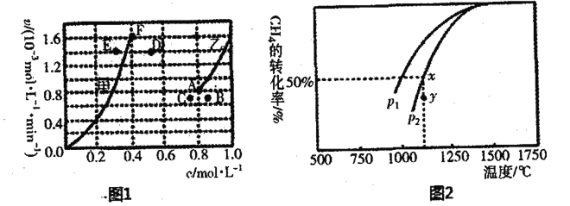
(1)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂 时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(选填“〉”、“=”或“<”),判断的理由是__________
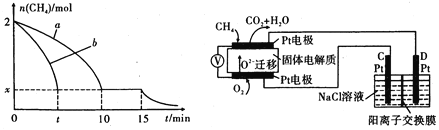
(4)科研人员设计了甲烷燃料电池并用于电解。如图所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液在25 0C时pH=_______ (假设电解前后NaCl溶液的体积均为500 mL)。
【答案】+ (4b-c-2a) kJmoL-1 0.16 b 升高温度或减小压强 12.8 > 温度升高,k正增大的倍数大于k逆 阳 CH4-8e-+4O2-=CO2+2H2O 12
【解析】
(1)ΔH=反应物总键能-生成物总键能;
(2)①根据v=Δc/Δt,同一反应,各物质速率比等于化学计量数之比分析作答;
②催化剂能加快反应速率,催化剂表面积越大,催化效果越好;
③反应为吸热反应,升高温度平衡向正反应方向进行,n(CH4)减小;反应物气体体积小于生成物,减小压强,平衡向正反应方向进行,n(CH4)减小;
(3)达到平衡时正逆反应速率相等,有v正=v逆,即k正c2(CH4)=k逆c(C2H4).c2(H2),则k正/k逆=c(C2H4)·c2(H2)/c2(CH4)=K,利用三段式把平衡常数K计算出来即可解答。该反应为吸热反应,升高温度,平衡正向移动;
(4)①对于燃料电池,通燃料一极为负极,通氧气一极为正极;对于电解池,连接电源正极的为阳极,连接电源负极的为阴极;
②根据图示,燃料电池的负极是甲烷生成H2O和CO2的反应;
③电解饱和食盐水的离子方程式为![]() ,再根据气体和OH-的比例关系计算OH-的浓度,再算出pH。
,再根据气体和OH-的比例关系计算OH-的浓度,再算出pH。
(1)ΔH=[2×4b-(c+4b)-2a]kJmoL-1=+(4b-c-2a) kJmoL-1,答案:+ (4b-c-2a)kJmoL-1;
(2)①![]() ,v(H2)=v(CH4)=0.16mol/(L·min),答案:0.16;
,v(H2)=v(CH4)=0.16mol/(L·min),答案:0.16;
②催化剂表面积越大,催化效果越好,速率越快,达到平衡所需的时间越短,所以曲线b的催化剂表面积较大,答案:b;
③15 min时,改变外界反应条件,导致n(CH4)减小,说明平衡向消耗CH4的方向移动,所以改变的条件可能是升高温度或减小压强,答案:升高温度或减小压强;
(3) 2CH4(g)![]() C2H4(g) +2H2(g)
C2H4(g) +2H2(g)
c始(mol/L) 2 0 0
Δc(mol/L)1.6 0.8 1.6
c末(mol/L) 0.4 0.8 1.6
T1温度时,该反应的平衡常数![]() ,且达到平衡时有v正=v逆,即k正c2(CH4)=k逆c(C2H4).c2(H2),则k正/k逆=c(C2H4).c2(H2)/c2(CH4)=K=12.8。该反应为吸热反应,所以升高温度,平衡正向移动,v正>v逆。答案:12.8;>;温度升高,k正增大的倍数大于k逆;
,且达到平衡时有v正=v逆,即k正c2(CH4)=k逆c(C2H4).c2(H2),则k正/k逆=c(C2H4).c2(H2)/c2(CH4)=K=12.8。该反应为吸热反应,所以升高温度,平衡正向移动,v正>v逆。答案:12.8;>;温度升高,k正增大的倍数大于k逆;
(4)①甲烷燃料电池,通燃料一极为负极,通氧气一极为正极,所以C极为电解池的阳极,D极为电解池的阴极;答案:阳;
②根据图示,燃料电池的负极是甲烷生成H2O和CO2的反应,所以电极反应为CH4-8e-+4O2-=CO2+2H2O,答案:CH4-8e-+4O2-=CO2+2H2O;
p>③根据离子方程式
 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6 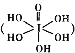 和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。
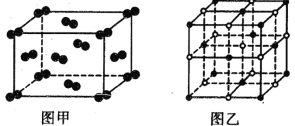
(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
【题目】实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。
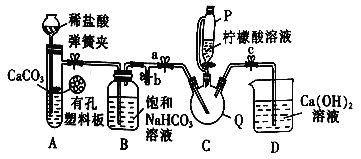
回答下列问题:
(1)仪器P的名称是_______。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH过低会使产率下降,其原因是______;柠檬酸的作用还有_____(填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____(填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____。