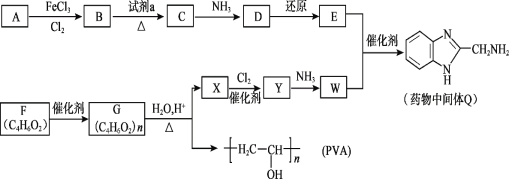
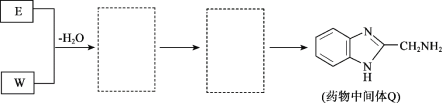
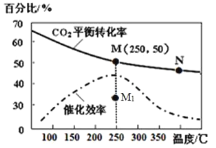
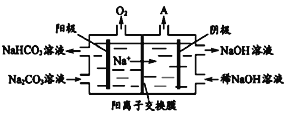
题目内容
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚(![]() )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
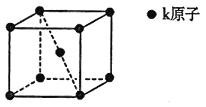
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

【答案】[ Ar]3d64s2 (或) 1s22s22p63s23p63d64s2 小于 Mn的3d能级为半充满的相对稳定结构,较难失电子 离子键 FeF3为离子晶体,FeBr3的化学键以共价键为主,属于分子晶体 N(或氮) sp3 6 6 ![]()
【解析】
(1)Fe为第26号元素,根据电子排布规律写出电子排布式;
(2)Fe的电子排布为[Ar]3d64s2,Mn的电子排布为[Ar]3d54s2,Mn的3d能级为半充满的相对稳定结构,较难失电子;
(3)根据熔点的差距推测晶体类型;
(4)①同周期从左到右,电负性逐渐增强,同主族从上到下,电负性逐渐减弱,而周期内变化比同族内变化要小得多;
②从苯酚的电子式可以看出,氧原子价层电子对数n=4,故为sp3杂化;形成大π键的原子数应为6个C原子,参与形成大π键的电子为C原子平行P轨道中的电子数,为6,
(5)由图可知:氮化铁晶胞的质量为![]()
晶胞的体积为![]()
根据公式可求![]()
(1)Fe为第26号元素,根据电子排布规律,可知Fe的电子排布为1s22s22p63s23p63d64s2或[Ar]3d64s2;
答案:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)Fe的电子排布为[Ar]3d64s2,Mn的电子排布为[Ar]3d54s2,Mn的3d能级为半充满的相对稳定结构, 较难失电子,故第一电离能Fe<Mn;
答案:小于;Mn的3d能级为半充满的相对稳定结构,较难失电子
(3)根据FeF3的熔点可知,FeF3属于离子晶体,故含离子键。FeBr3熔点明显低于FeF3,两者晶体类型不同,FeBr3的化学键以共价键为主, 属于分子晶体;
答案:离子键;两者晶体类型不同,FeBr3的化学键以共价键为主,属于分子晶体。
(4)①同周期从左到右,电负性逐渐增强,同主族从上到下,电负性逐渐减弱,而周期内变化比同族内变化要小得多,根据三种元素位置关系可知,N元素电负性最强。
答案:氮或N
②从苯酚的电子式可以看出,氧原子价层电子对数n=4,故为sp3杂化;形成大π键的原子数应为6个C原子,参与形成大π键的电子为C原子平行P轨道中的电子数,为6,
答案:sp3;6, 6
(5)由图可知:氮化铁晶胞的质量为![]()
晶胞的体积为![]()
根据公式可求![]()
答案:![]()

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案