题目内容
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
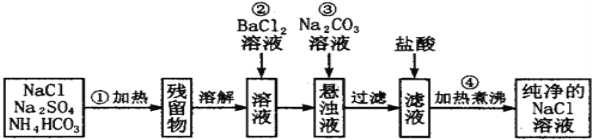
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
【答案】否 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3- 静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽 除去滤液中溶解的CO2和多余的盐酸 ①③⑥ 蒸发浓缩 降温结晶 41.7 c d
【解析】
Ⅰ(1) 操作②改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠;
(2) 用氯化钡溶液来判断SO42- 是否已除尽;
(3)操作④进行加热煮沸,可以除去滤液中溶解的CO2和多余的盐酸;
Ⅱ(1)根据过滤操作中所用到的玻璃仪器选用所需的仪器;
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;
(3)根据溶液稀释前后溶质的量不变,计算出所需浓硫酸的体积;根据c=n/V进行分析,凡是引起n偏小或V偏大,所测定的结果都会使所配溶液浓度偏低。
Ⅰ(1)本实验的目的最终得到纯净的氯化钠溶液,因此操作②中改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠,因此不能用Ba(NO3)2溶液代替BaCl2溶液;综上所述,本题答案是:否,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-。
(2) 操作②,加入氯化钡溶液,目的是除去硫酸根离子,因此判断SO42- 已除尽方法是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽;综上所述,本题答案是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽。
(3)滤液中剩余的碳酸钠与过量的盐酸反应生成二氧化碳、氯化钠,因此操作④进行的加热煮沸,其目的是除去滤液中溶解的CO2和多余的盐酸;综上所述,本题答案是:除去滤液中溶解的CO2和多余的盐酸。
Ⅱ(1)进行过滤操作,所用到的玻璃仪器有①漏斗,③烧杯,⑥玻璃棒;综上所述,本题答案是:①③⑥。
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;本题中一系列操作”依次为加热浓缩、降温结晶和过滤;综上所述,本题答案是:蒸发浓缩 ;降温结晶。
(3)根据溶液稀释前后溶质的量不变规律,实验室没有240mL容量瓶,只能选用250mL容量瓶,因此18×V(浓H2SO4)=250×3, V(H2SO4)=41.7mL;实验时,下列操作会造成偏低的是:
a.容量瓶内壁附有水珠而未干燥处理,不影响溶质的量和溶液的体积,对无影响,不选;
b.未冷却至室温直接转移至容量瓶中,等溶液冷却到室温后,溶液的体积会偏小,所配溶液浓度偏大,不选;
c.加水时超过刻度线后又倒出,造成溶质的量减少,所配溶液浓度偏低,可选;
d.定容时仰视刻度线,造成溶液的体积偏高,所配溶液浓度偏低,可选;
综上所述,本题正确答案是:41.7 ,cd。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案