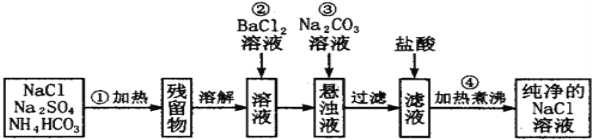
题目内容
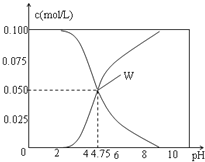
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
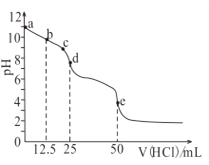
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
【答案】C
【解析】A,b点加入12.5mL的盐酸,得到等物质的量浓度的NaHCO3、Na2CO3和NaCl的混合液,由于CO32-的水解能力大于HCO3-的水解能力,则c(HCO3-)![]() c(CO32-)
c(CO32-)![]() c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。
c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。

练习册系列答案
相关题目