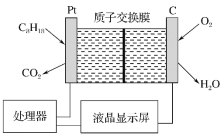
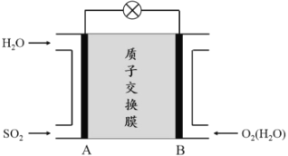
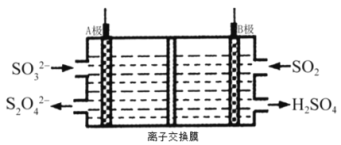
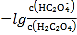题目内容
【题目】25℃时,现有浓度均为0.10mol/L的三种溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。请回答:
(1)三种溶液中,pH>7的是__________(填序号),其原因是________________________________________(用离子方程式表示)。pH<7的是__________(填序号),其原因是________________________________________(用化学用语表示)。
(2)下列说法正确的是__________(填序号)。
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是_____________________
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是____________,此时溶液的pH是____________(不考虑溶液体积的变化)。
【答案】② CH3COO-+H2OCH3COOH+OH- ③ CH3COOHCH3COO-+H+ c c (CH3COO-)> c(Na+)> c (H+)> c(OH-) 2Cl+2H2O 2OH+H2↑+Cl2↑ 13
2OH+H2↑+Cl2↑ 13
【解析】
(1) 强碱强酸盐溶液不水解显中性,强碱弱酸盐水解显碱性;醋酸电离显酸性;
(2)能够水解的盐促进水电离,溶液中存在电荷守恒;
(3)二者混合后,溶质为等物质的量CH3COONa和CH3COOH,溶液中存在平衡CH3COO+H2OCH3COOH+OH-、CH3COOHCH3COO+H+,由于溶液pH<7说明电离程度大于水解程度,据此分析各离子浓度大小关系;
(4)电解饱和食盐水,阴极生成氢气,阳极生成氯气,根据反应关系计算产生的n(OH),进而计算出c(OH)。
(1)氯化钠溶液为强碱强酸盐溶液呈中性,25℃时pH=7;CH3COONa溶液为强碱弱酸盐,醋酸根水解CH3COO-+H2OCH3COOH+OH-,溶液显碱性,25℃时pH>7;CH3COOH溶液为弱酸溶液,存在醋酸的电离CH3COOHCH3COO-+H+,溶液显酸性,25℃时pH<7;
(2)a.CH3COONa在水溶液中完全电离成醋酸根和钠离子,是强电解质,故a错误;
b. 醋酸钠中醋酸根水解促进水的电离,醋酸溶液中醋酸的电离抑制水的电离,故b错误;
c. ①②两种溶液等体积混合后溶液中存在电荷守恒c(Na+)+c (H+)=c (Cl-)+c (CH3COO-)+c (OH-),故c正确,所以选c;
(3)二者混合后,溶质为等物质的量CH3COONa和CH3COOH,溶液中存在平衡CH3COO+H2OCH3COOH+OH-、CH3COOHCH3COO+H+,由于溶液pH<7说明电离程度大于水解程度,所以溶液中的c (CH3COO-)> c (CH3COOH),溶液中存在物料守恒2c(Na+)= c (CH3COO-)+c (CH3COOH),所以c (CH3COO-)> c(Na+),所以溶液中离子浓度大小关系为c (CH3COO-)> c(Na+)> c (H+)> c(OH-);
(4)电解饱和食盐水,阴极生成氢气,阳极生成氯气,离子方程式为:2Cl+2H2O 2OH+H2↑+Cl2↑;生成的氢气的物质的量为
2OH+H2↑+Cl2↑;生成的氢气的物质的量为![]() =0.05mol,根据方程式可知生成的n(OH)=0.1mol,则c(OH)=
=0.05mol,根据方程式可知生成的n(OH)=0.1mol,则c(OH)=![]() =0.1mol/L,溶液pH=13。
=0.1mol/L,溶液pH=13。

【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O